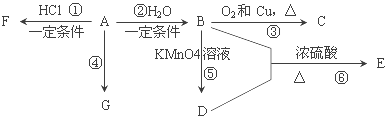
题目内容
【题目】下列有关实验误差分析中,不正确的是( )
A.用湿润的pH试纸测稀碱液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低
【答案】B
【解析】pH试纸上的水对稀碱液起到稀释作用,造成pH测定值偏小,A正确;容量瓶配制溶液,定容时俯视读数,溶液体积偏小,所配溶液浓度偏大,B错误;中和滴定终点读数时有气泡,气泡占有体积造成所测体积偏小,C正确;缓慢倒入碱,与酸反应的一部分热量损失,所测温度值偏低,D正确。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一。
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法。已知:
① C(s)+ O2 (g) = CO2 (g) ΔH = -393.5 kJ·mol-1
② CO(g) + ![]() O2 (g) = CO2 (g) ΔH = -283.0 kJ·mol-1
O2 (g) = CO2 (g) ΔH = -283.0 kJ·mol-1
③ H2(g) + ![]() O2 (g) = H2O (g) ΔH = -241.8 kJ·mol-1
O2 (g) = H2O (g) ΔH = -241.8 kJ·mol-1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 ,该反应的化学平衡常数K随温度的升高将 (填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g) + H2O(g)![]() CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
甲 n/ mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/ mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向 (填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 。

②右图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的所有可能的条件是 。
(3)以CO为燃料制作燃料电池,电池的正极入O2和CO2,负极通入CO,电解质是熔融碳酸钠,工作时负极反应式为 ,若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下) L。