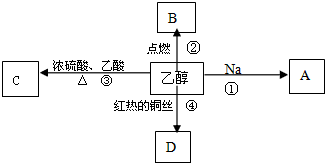
��Ŀ����
13��ú������ҵ����Ҫ��Ʒ֮һ�״�����һ�����͵���������ȼ�ϣ�������ҵ�һ��ͨ��CO��H2�����Ʊ��״�����Ӧ���º��ݣ����÷�Ӧ�Ļ�ѧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����1��������������˵��������Ӧ�Ѵ�ƽ�����AC��
A�������������ƽ��Ħ���������ֲ���
B��2v��H2����=v��CH3OH����
C�������������ѹǿ���ֲ���
D����λʱ��������nmol CO��ͬʱ����2nmol H2
��2�����ݻ��̶��ĺ����ܱ������г���CO��H2����������Ӧ����Ӧ�ڵ�4minʱ��ﵽ���ȣ���ʱ������ѹǿ�뷴Ӧǰ֮��Ϊ3��5�����������ʵĸ������ʵ���Ũ�����±���
| ʱ��/Ũ�� | c��CO����mol/L�� | c��H2����mol/L�� | c��CH3OH����mol/L�� |
| ��ʼ | 0.200 | 0.300 | 0.000 |
| ��4min | a | b | c |
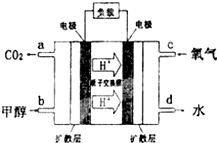
��3���״�-����ȼ�ϵ�أ�DMFC����һ�ָ�Ч�ܡ����� Ⱦ�綯�����ij��ص�أ��乤��ԭ����ͼ��ʾ����ȼ�ϵ�صĵ�ط�ӦʽΪ2CH3OH��g��+3O2��g���T2CO2��g��+4H2O��l�������ĵ缫��ӦʽΪCH3OH-6e-+H2O=CO2+6H+������õ�ع���ʱ��·��ͨ��1.2mol���ӣ�������CH3OH��0.2mol��
���� ��1�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ������䡢���ʵ���Ũ�Ȳ��䡢�ٷֺ��������Լ��ɴ������һϵ�����������䣻
��2�����¡����������£���Ӧǰ����������ʵ���Ũ��֮�ȵ�����ѹǿ֮�ȣ���Ӧǰ����������ʵ���Ũ��֮��=��0.200+0.300��mol/L=0.500mol/L����Ӧǰ���������ѹǿ֮��Ϊ5��3����Ӧ�����������ʵ���Ϊ0.300mol/L�����ò��������㣻
��3��ȼ�ϵ���У�������ͨ��ȼ�ϡ�������ͨ�������������Ը�ȼ�ϵ���У������ϼ״�ʧ���Ӻ�ˮ��Ӧ���ɶ�����̼�������ӣ�����ת�Ƶ��Ӻͼ״�֮��Ĺ�ϵʽ�������ļ״������ʵ�����
��� �⣺��1��A����Ӧǰ������������ʵ����ı䣬���Է�Ӧǰ�������������ƽ��Ħ�������ı䣬���������ƽ��Ħ����������ʱ���÷�Ӧ�ﵽƽ��״̬����A��ȷ��
B��2v��H2����=v��CH3OH��������ѧ��Ӧ����֮�Ȳ����ڻ�ѧ������֮�ȣ�֤�����������ʲ��ȣ���B����
C������������ԣ��÷�Ӧ����һ��������������ʵ����ķ�Ӧ�������������ѹǿ������������ʵ����ı仯���仯����ѹǿ����˵�����ڻ�ѧƽ��״̬����C��ȷ��
D������n molCO��ͬʱ����2n mol H2�������淴Ӧ���ʣ�����˵��������������ȣ���D����
�ʴ�Ϊ��AC��
�ں��º�ѹ�����£������ѹǿ�����ʵ���Ũ�ȳ����ȣ�ƽ��ʱ�����Ũ�Ⱥ�Ϊ����0.200+0.300��mol/L��$\frac{3}{5}$=0.300mol/L����c=0.500mol/L-0.300mol/L=0.200mol/L��
CO ��g��+2H2��g��?CH3OH��g����n
1 2 1 2
x 0.200mol/L
x=0.200mol/L�����b=0.300mol/L-0.200mol/L=0.100mol/L��
�ʴ�Ϊ��0.100��
��4����ȼ��״��ڸ���ʧȥ�������ɶ�����̼�������缫��ӦʽΪ��CH3OH-6e-+H2O=CO2+6H+�����ݵ缫��Ӧʽ֪������õ�ع���ʱ��·��ͨ��1.2mol���ӣ�������CH3OH���ʵ���=$\frac{1.2mol}{6}��1$=0.2mol��
�ʴ�Ϊ��CH3OH-6e-+H2O=CO2+6H+��0.2��
���� ���⿼�黯ѧƽ����㡢ԭ���ԭ������ѧƽ��״̬�жϵ�֪ʶ�㣬Ϊ��Ƶ���㣬ע�⣺ֻ�з�Ӧǰ��ı�����ʵ�������ʱ�÷�Ӧ���ܴﵽƽ��״̬���ѵ��ǵ缫��Ӧʽ����д��Ҫ��ϵ������Һ�������д��

 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�| A�� | ����ϩ���ϵ��ϻ�����Ϊ�����˼ӳɷ�Ӧ | |
| B�� | ú����������Һ���������仯����ת��Ϊ�����Դ | |
| C�� | ������ʳ��ƾ����˵��ۡ������ǡ��Ҵ��Ļ�ѧ�仯�Ĺ��� | |
| D�� | �ϳ���ά��������ά��̼��ά�������л��߷��Ӳ��� |
| A�� | ���Ӿ�����ÿ��������Χ��������6�����෴��ɵ����� | |
| B�� | �ھ����У�����������һ������������ | |
| C�� | ���Ӿ�����һ�����������Ӽ�����һ�����ڹ��ۼ� | |
| D�� | ԭ�Ӿ����еĸ�����ԭ�Ӷ��Թ��ۼ���� |
| A�� | ����Na2SO4��Һ | B�� | ����ϡ���ᣬ����98%Ũ���� | ||
| C�� | �μ�����CuSO4��Һ | D�� | ������Ƭ���������� |
| A�� | ����һ�����ʵ���Ũ�ȵ���Һ����������ʱ����������λ�õߵ� | |
| B�� | ����һ�����ʵ���Ũ�ȵ���Һ������ʱ���ӿ̶��� | |
| C�� | ��Ũ�������ռ��ϡ��Һ��Ӧ���ⶨ�к��ȵ���ֵ | |
| D�� | ��10.0mL����Ͳ��ȡ7.8mLŨ����ʱ���Ӷ��� |
| A�� | ������̼ | B�� | �������� | C�� | ������̼ | D�� | ����������� |