题目内容
16.写出下列反应的离子反应方程式.(1)NaHSO4溶液与NaHCO3溶液反应H++HCO3-═CO2↑+H2O
(2)NaHSO4溶液与Ba(OH)2溶液充分混合,溶液pH=7Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓
(3)将少量SO2通入到氨水中SO2+2NH3•H2O═2NH4++SO32-+H2O
(4)向含0.6mol的FeBr2溶液中通入0.8mol Cl2(已知氧化性Cl2>Br2>Fe3+)8Cl2+10Br-+6Fe2+═6Fe3++16Cl-+5Br2.
分析 (1)NaHSO4溶液与NaHCO3溶液反应生成硫酸钠和水、二氧化碳;
(2)NaHSO4溶液与Ba(OH)2溶液充分混合,溶液pH=7,则二者反应产物为硫酸钡和水、硫酸钠;
(3)少量SO2通入到氨水,反应生成亚硫酸铵和水;
(4)二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,再氧化溴离子.
解答 解:(1)NaHSO4溶液与NaHCO3溶液反应生成硫酸钠和水、二氧化碳,离子方程式:H++HCO3-═CO2↑+H2O;
故答案为:H++HCO3-═CO2↑+H2O;
(2)NaHSO4溶液与Ba(OH)2溶液充分反应溶液呈中性,则生成产物为硫酸钡和水、硫酸钠,离子方程式为:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓;
故答案为:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓;
(3)少量SO2通入到氨水,反应生成亚硫酸铵和水,离子方程式:SO2+2NH3•H2O═2NH4++SO32-+H2O;
故答案为:SO2+2NH3•H2O═2NH4++SO32-+H2O;
(4)向含0.6mol的FeBr2溶液中通入0.8mol Cl2,二价铁离子全部被氧化,溴离子部分被氧化,离子方程式:8Cl2+10Br-+6Fe2+═6Fe3++16Cl-+5Br2;
故答案为:8Cl2+10Br-+6Fe2+═6Fe3++16Cl-+5Br2.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列混合物的分离方法不正确的是( )
| A. | 泥沙和食盐(溶解,过滤) | B. | 汽油和水(分液) | ||
| C. | KNO3和KCl(降温结晶) | D. | 酒精和水(分液) |
7.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电.下列有关分析正确的是( )
| A. | K3C60和C60中都含有共价键 | |
| B. | 钾的核外电子排布为:1s22s22p63s23p63d104s1 | |
| C. | K3C60和C60都属于分子晶体,具有较低的熔点 | |
| D. | C60与12C互为同素异形体 |
4.对于反应A(g)+3B(g)??2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A. | v(A)=0.02mol/(L•s) | B. | v(B)=0.03mol/(L•s) | ||
| C. | v(B)=0.90mol/(L•min) | D. | v(C)=0.60mol/(L•min) |
1.下列有关离子方程式与所述事实相符且正确的是( )
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2H++CO32-═BaCO3↓+2H2O | |
| C. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3 H+ | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
8.取c(H+)均为0.5mol/L的盐酸和醋酸各100mL,分别加水稀释两倍后,再分别加入0.65g锌粉,相同条件下充分反应,下列说法中,正确的是( )
| A. | 将锌反应完所需的时间相同 | B. | 起始时醋酸与锌反应的速率大 | ||
| C. | 醋酸与锌反应放出的氢气多 | D. | 两者放出的氢气一样多 |
6.在配制一定物质的量浓度的溶液的实验中,下列操作正确的是( )
| A. | 欲配制1000mL 0.1mol•L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线2cm时,再用胶头滴管加水至刻度线 | |
| B. | 将准确量取的18.4mol•L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线,即可制得100mL稀硫酸 | |
| C. | 仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 | |
| D. | 将氢氧化钠固体放在有滤纸的天平托盘上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
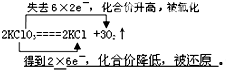 .
. 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.