题目内容
4.对于反应A(g)+3B(g)??2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )| A. | v(A)=0.02mol/(L•s) | B. | v(B)=0.03mol/(L•s) | ||
| C. | v(B)=0.90mol/(L•min) | D. | v(C)=0.60mol/(L•min) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率与其化学计量数比值越大,表示的反应速率越快,注意保持单位一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率与其化学计量数比值越大,表示的反应速率越快,
A.v(A)=0.02mol/(L•s)=1.2mol/(L•min),则$\frac{v(A)}{1}$=1.2mol/(L•min);
B.v(B)=0.03mol/(L•s)=1.8mol/(L•min),则$\frac{v(B)}{3}$=0.6mol/(L•min);
C.$\frac{v(C)}{2}$=0.45mol/(L•min);
D.$\frac{v(C)}{2}$=0.3mol/(L•min),
故选:A.
点评 本题考查反应速率快慢的比较,利用比值法可以迅速判断,也可转化为同种物质的反应速率比较,注意保持单位一致,题目难度不大.

练习册系列答案
相关题目
15.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
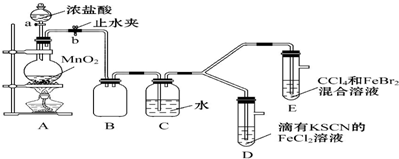
(1)检查气体发生装置A的气密性的操作是关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D装置中又有新的变化:红色慢慢褪去.
①为了探究溶液“红色慢慢褪去”的原因,进行如下实验.
取D中溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.取D中溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.实验证明“红色慢慢褪去”的原因是过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
②猜测SCN-可能被Cl2氧化了,又进行了如下研究.
资料显示:
SCN-的电子式为 ,认为SCN-中碳元素没有被氧化,理由是SCN-中碳元素是最高价态+4价.取D中溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.通过实验证明了SCN-中氮元素转化为NO3-,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
,认为SCN-中碳元素没有被氧化,理由是SCN-中碳元素是最高价态+4价.取D中溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.通过实验证明了SCN-中氮元素转化为NO3-,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
(4)整套实验装置存在一处明显不足,请在下面的方框内画出相应的改进装置.


(1)检查气体发生装置A的气密性的操作是关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红色;E装置中:水层溶液变黄色,振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+氧化性由强到弱的顺序为Cl2>Br2>Fe3+ |
①为了探究溶液“红色慢慢褪去”的原因,进行如下实验.
取D中溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.取D中溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.实验证明“红色慢慢褪去”的原因是过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色.
②猜测SCN-可能被Cl2氧化了,又进行了如下研究.
资料显示:
SCN-的电子式为
 ,认为SCN-中碳元素没有被氧化,理由是SCN-中碳元素是最高价态+4价.取D中溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.通过实验证明了SCN-中氮元素转化为NO3-,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
,认为SCN-中碳元素没有被氧化,理由是SCN-中碳元素是最高价态+4价.取D中溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.通过实验证明了SCN-中氮元素转化为NO3-,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.(4)整套实验装置存在一处明显不足,请在下面的方框内画出相应的改进装置.

12.己知:2Fe+3Br2=2FeBr3,Fe2+的还原性大于Br-.现有16.8g铁和0.3mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2.下列叙述不正确的是( )
| A. | 当a=0.1时,发生的反应为2Fe2++Cl2-2Fe3++2C1- | |
| B. | 当a=0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| C. | 若溶液中Br-有一半被氧化时,c (Fe3+):c(Br-):c (Cl-)-1:1:3 | |
| D. | 当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c (Fe3+)+c(H)=c(C1-)+c(Br-)+c(OH-) |
19.在1981年才第一次制得卤族元素的第五个成员砹,根据卤素性质的变化规律,我们可以预料砹的下列性质
不正确的是( )
不正确的是( )
| A. | 砹单质在室温下的状态是固体,颜色比碘深,单质能溶于四氯化碳 | |
| B. | 砹原子得电子能力比碘强 | |
| C. | AgAt的颜色比AgI 深,HAt的稳定性比HI弱 | |
| D. | 单质砹是卤素中弱氧化剂,而砹离子是卤族中的强还原剂 |
9.120mL含有2mol碳酸钠的溶液和200mL,1.5mol•L-1盐酸,不管将前者滴加入后者,还是将后者滴加入前者,下列叙述正确的是( )
| A. | Na2CO3溶液中加盐酸,无气体生成 | |
| B. | 盐酸中加入Na2CO3溶液,开始无气体,后有气体生成 | |
| C. | 无论怎么滴加,都有气体生成,且生成的气体一样多 | |
| D. | 无论怎么滴加,都有气体生成,且盐酸中滴加Na2CO3溶液产生的气体多 |
 一定温度下体积为5L的密闭容器中发生可逆反应.
一定温度下体积为5L的密闭容器中发生可逆反应.