题目内容
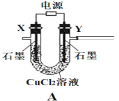
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
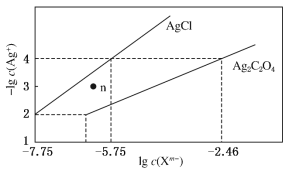
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
【答案】D
【解析】
A.Ksp(Ag2C2O4)=c2(Ag+)c(C2O42-)=(10-4)2×(10-2.46)=10-10.46,故数量级为10-11,故A错误;
B.-lg c(Ag+)越小,c(Ag+)越大,根据图像,在n点,c(Ag+)大于平衡浓度,故n点的浓度积Qc(AgCl)>Ksp(AgCl),为氯化银的过饱和溶液,将有沉淀析出,故B错误;
C.根据图像可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小,故向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C错误;
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数K=
2AgCl(s)+C2O42-(aq)的平衡常数K=![]() ,此时溶液中的c(Ag+)相同,故有K=
,此时溶液中的c(Ag+)相同,故有K=![]() =
=![]() =109.04,故D正确;
=109.04,故D正确;
答案选D。

【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如图:
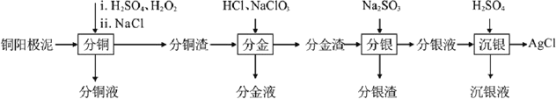
已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
ⅲ“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率/% | 85.7 | 0 | 4.5 | 93.5 |
(1)由表中数据可知,Ni的金属性比Cu____。分铜渣中银元素的存在形式为_________(用化学用语表示)。
(2)“分金”时,单质金发生反应的离子方程式为____。
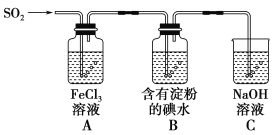
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。
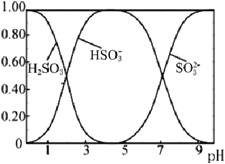
“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为__。调节溶液的pH不能过低,理由为__(用离子方程式表示)。
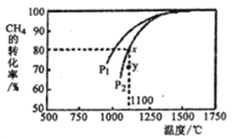
(4)工业上,用镍为阳极,电解0.1mol/LNiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
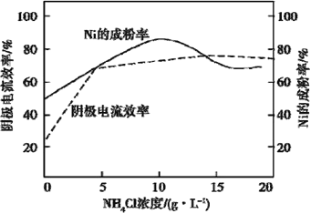
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_____g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_____。