��Ŀ����
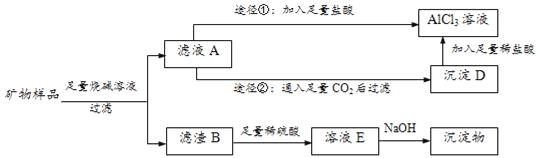
����Ŀ��ij������Ʒ���Ѿ����������ʣ������������Al2O3��Fe2O3��CuO����ѧ��ȤС���������ֽ�����������Է��룬�����Ƶ���Ӧ�Ĵ������������Һ��ʵ�鷽���������£�
��1����Fe2O3��CuO����ɫ������___ɫ��___ɫ��
��2��д����ҺA����Ҫ���ʳɷ֣�___��
��3������ҺA��AlCl3��Һ�Тٺ͢�����;���������������������֮���������ǣ�___��
��4����ҺE�к������������ӣ���E�зֲ��μ�NaOH��Һ�������������Ⱥ���OH����ϣ������еڶ�λ����������ʹij���Լ���ΪѪ��ɫ�������Լ���___����������Ʒ������Ϊm1������Fe(OH)3������Ϊm2������Ʒ��Fe2O3����������Ϊ___����ʹFe3+������һ�������NaOH�������òⶨֵ��___������ƫ��������ƫ������������������
��5����Cu(OH)2����ϡ���ᣬȻ���Ƴɵ������壬��Ҫ�IJ����������ΰ�������Ũ����___��___��ϴ�ӡ���Ȼ����ȡ�
���𰸡����� �� NaOH��NaAlO2 ;�����Ƶõ��Ȼ�����Һ���ȸ�,;������ȡ��AlCl3��Һ�л���NaCl���� KSCN��Һ ![]() ��100% ƫ�� ��ȴ�ᾧ ����
��100% ƫ�� ��ȴ�ᾧ ����
��������
������Ʒ���Ѿ����������ʣ������������Al2O3��Fe2O3��CuO�����������ռ���Һ���ˣ��������ܽ�����ƫ�����ƣ�������������ͭ���ܽ⣬��ҺAΪNaAlO2������NaOH������BΪFe2O3��CuO����������ϡ�����ܽ�õ�������������ͭ��ҺE����������������Һ���ɳ�������������������ͭ����ҺA�����������������Ȼ������Ȼ�����Һ����ҺAͨ������������̼���˵õ�������������D�������м�������ϡ����õ��Ȼ�����Һ��
��1��������Ϊ����ɫ������ͭΪ��ɫ��
��2��������֪��ҺAΪƫ��������Һ������������Һ��
��3���������ʵ����ʽ�Ͽ�ͼת����ϵ�����ò�Ʒ���н��
��4����ҺE�к������������ӣ�ΪH+��Fe3+��Cu2+����E�зֲ��μ�NaOH��Һ�������������Ⱥ���OH-��ϣ������еڶ�λ����������ʹij���Լ���ΪѪ��ɫΪ�����ӽ���������������Ѫ��ɫ��Һ��Ԫ���غ����������������������ʹFe3+������һ�������NaOH����������������ͭ������������������
��5������Һ��Ҫ�������壬������ȴ�ᾧ����Ȼ�����ϴ�ӡ����
������Ʒ���Ѿ����������ʣ������������Al2O3��Fe2O3��CuO�����������ռ���Һ���ˣ��������ܽ�����ƫ�����ƣ�������������ͭ���ܽ⣬��ҺAΪNaAlO2������NaOH������BΪFe2O3��CuO����������ϡ�����ܽ�õ�������������ͭ��ҺE����������������Һ���ɳ�������������������ͭ����ҺA�����������������Ȼ������Ȼ�����Һ����ҺAͨ������������̼���˵õ�������������D�������м�������ϡ����õ��Ȼ�����Һ��
��1����Fe2O3��CuO����ɫ�����Ǻ���ɫ����ɫ��
�ʴ�Ϊ�����أ��ڣ�
��2����ҺA����Ҫ���ʳɷ�Ϊ�������������ƺ����ɵ�ƫ�����ƣ���ѧʽΪ��NaOH��NaAlO2��
�ʴ�Ϊ��NaOH��NaAlO2��
��3��;���ٷ�����Ӧ��NaAlO2+4HCl=AlCl3+NaCl+2H2O��NaOH+HCl=NaCl+H2O���������ᣬ�Ȼ������ʣ�
�ʴ�Ϊ��;�����Ƶõ��Ȼ�����Һ���ȸߣ�;������ȡ��AlCl3��Һ�л���NaCl���ʣ�
��4����ҺE�к������������ӣ�ΪH+��Fe3+��Cu2+����E�зֲ��μ�NaOH��Һ�������������Ⱥ���OH����ϣ������еڶ�λ����������ʹij���Լ���ΪѪ��ɫΪ�����ӽ���������������Ѫ��ɫ��Һ���Լ�ΪKSCN��Һ��Ԫ���غ������������������=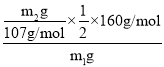 ��100%=
��100%=![]() ��100%����ʹFe3+������һ�������NaOH����������������ͭ��������������������õ�����������������ƫ�ߣ�
��100%����ʹFe3+������һ�������NaOH����������������ͭ��������������������õ�����������������ƫ�ߣ�
�ʴ�Ϊ��KSCN��Һ��![]() ��100%��ƫ�ߣ�
��100%��ƫ�ߣ�
��5������Һ��ȡ���壬�辭������Ũ������ȴ�ᾧ������ϴ�ӡ�����ſɵõ�����Cu(OH)2����ϡ���ᣬȻ���Ƴɵ������壬��Ҫ�IJ����������ΰ�������Ũ������ȴ�ᾧ������ϴ�ӡ����
�ʴ�Ϊ����ȴ�ᾧ�����ˡ�

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�