题目内容
17.2012年太钢不锈钢年产量居世界第一.(1)赤铁矿的主要成分是Fe2O3,Fe2O3中铁、氧元素的质量比是7:3.
(2)根据化学方程式计算,若太钢每天生产8400t铁,需要含Fe2O380%的赤铁矿的质量是多少?
分析 (1)依据三氧化二铁化学式可知铁与氧原子个数之比为2:3,依据m=nM计算其质量之比;
(2)依据每天生产铁的质量依据三氧化二铁中铁的质量分数,依据方程式 Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,计算需要赤铁矿的质量.
解答 解:(1)三氧化二铁化学式可知铁与氧原子个数之比为2:3,Fe2O3中铁、氧元素的质量比=(56×2):(16×3)=7:3,
故答案为:7:3;
(2)设需要含Fe2O380%的赤铁矿的质量为xt,则:
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
80%×x 8400t
160:0.8x=112:8400t,
解得x=15000t,
答:需要含Fe2O380%的赤铁矿的质量15000t.
点评 本题考查了物质的组成和有关方程式的计算,明确发生的反应准确判断相关物质之间量的关系是解题关键,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
7.运用化学反应原理研究NH3的性质具有重要意义.
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.
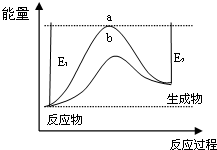
①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
①则2~4min内,v(O2)=0.0625mol/(L.min).
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.

①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
8.下列反应中,属于取代反应的是( )
| A. | CH4$\stackrel{高温}{→}$C+2H2 | |
| B. | CH3CH=CH2+Br2$\stackrel{CCl_{4}}{→}$CH3CHBrCH2Br | |
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| D. | C2H6+Cl2$\stackrel{光}{→}$C2H5Cl+HCl |
5.下列物质可以用溶解、过滤、洗涤、干燥的方法除去括号内杂质的是( )
| A. | 氧化铜(铜) | B. | 碳酸钙(氯化银) | C. | 氢氧化铁(氯化铁) | D. | 氢氧化钠(氯化钠) |
2.下列有关说法正确的是( )
| A. | 常温下,0.1mol•L-1 Na2S溶液中存在:c(OH-)=c(H+ )+c(HS-)+c(H2S) | |
| B. | PH=3的醋酸溶液中:c(H+ )=c(CH3COO-)=0.3mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH- )=1×10-a mol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+ )>c(OH- ) |
9.元素A的原子最外层有6个电子,元素B的原子最外层有3个电子,则A与B形成的化合物可能的化学式是( )
| A. | B2A3 | B. | B2A | C. | BA2 | D. | BA |
6.下列说法中,正确的是( )
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 分子中共价键的键能越大,该物质的性质越不活泼 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 若把H2S写成H3S,违背了共价键的饱和性 |
