题目内容
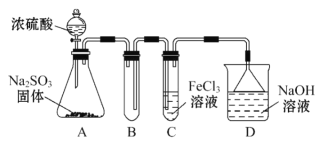
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
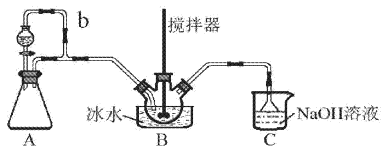
(1)装置A制取SO2
①A中反应的化学方程式为___。
②导管b的作用是___。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___(只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___。
(3)装置C的主要作用是___(用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+__C2O42-+__=__Mn2++__+__H2O
②滴定终点时的现象为___。
③亚硝酰硫酸的纯度=___。(精确到0.1%)[M(NOSO4H)=127g·mol-1]
【答案】Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 平衡压强,使分液漏斗中的液体能顺利流下; 调节分液漏斗活塞,控制浓硫酸的滴加速度 生成的NOSO4H作为该反应的催化剂 SO2+2OH-=SO32-+H2O C装置中的水蒸气会进入B中使NOSO4H分解 2 5 16H+ 2 10CO2↑ 8 溶液恰好由粉红色变为无色,且半分钟内不恢复 92.0%
【解析】
(1)①装置A是利用亚硫酸钠和浓硫酸反应制取SO2;
②导管b的作用平衡压强的作用;
(2)①装置B中浓硝酸与二氧化硫在浓硫酸的作用下反应制得NOSO4H,该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,结合反应的操作;
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率加快,说明NOSO4H起到了催化作用;
(3)装置C主要作用是吸收二氧化硫防止污染空气;
(4)NOSO4H遇水分解;
(5)①高锰酸钾溶液在酸性条件下氧化草酸钠生成二氧化碳,结合元素化合价变化和电子守恒、原子守恒配平书写离子反应方程式;
②高锰酸钾自身在反应中的颜色变化就可作为终点判断指示剂;
③根据反应2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,结合滴定中消耗高锰酸钾的物质的量可得到亚硝酰硫酸的物质的量,据此计算纯度。
(1)①利用装置A,固液混合制取二氧化硫,其方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
②导管b的作用是:平衡压强,使分液漏斗中的液体能顺利流下;
(2)①浓硫酸遇水放出大量热,维持体系温度不得高于20℃,还可以是调节分液漏斗活塞,控制浓硫酸的滴加速度;
②开始反应缓慢,待生成少量NOSO4H后,反应速率明显加快,温度变化不大,排除温度的影响,其原因是:生成的NOSO4H作为该反应的催化剂,加快了反应速率;
(3)装置C利用NaOH溶液将剩余的SO2吸收,防止污染环境,方程式为SO2+2OH-=SO32-+H2O;
(4)NOSO4H遇水分解,C装置(或A)中的水蒸气会进入B中使NOSO4H发生分解;
(5)①发生的是MnO4-和C2O42-的氧化还原反应,MnO4-做氧化剂,被还原成生成Mn2+,C2O42-做还原剂,被氧化成二氧化碳。结合得失电子守恒和电荷守恒可得到MnO4-和C2O42-的离子反应方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
②利用草酸钠溶液滴定酸性KMnO4溶液,滴定终点时的现象为:溶液恰好由粉红色变为无色,且半分钟内不恢复;
③根据题意可知,酸性KMnO4溶液先与NOSO4H反应,利用草酸钠溶液滴定剩余酸性KMnO4溶液。用0.2500mol·L-1草酸钠标准溶液滴定酸性KMnO4溶液,消耗草酸钠溶液的体积为20.00mL。可知剩余的KMnO4的物质的量n1(MnO4-)=![]() n(C2O42-)=
n(C2O42-)=![]() ×0.2500mol·L-1×20.00×10-3L=2×10-3mol,则亚硝酰硫酸消耗的KMnO4的物质的量n2(MnO4-)=0.1000mol·L-1·60.00×10-3L-2×10-3mol=4×10-3mol。n(NOSO4H)=
×0.2500mol·L-1×20.00×10-3L=2×10-3mol,则亚硝酰硫酸消耗的KMnO4的物质的量n2(MnO4-)=0.1000mol·L-1·60.00×10-3L-2×10-3mol=4×10-3mol。n(NOSO4H)=![]() n2(MnO4-)=10-2mol,亚硝酰硫酸的纯度=
n2(MnO4-)=10-2mol,亚硝酰硫酸的纯度=![]() ×100%=
×100%=![]() ×100%=92.0%。
×100%=92.0%。