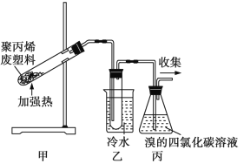
题目内容
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
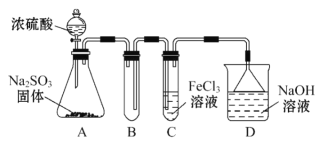
(1)通入足量SO2时C中观察到的现象为____。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___;
②C装置中所盛装的FeCl3溶液为5mL,物质的量浓度为2.0mol·L-1,欲使其完全被SO2还原,则至少需要Na2SO3固体___g;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO![]() 。该做法___(填“合理”或“不合理”),理由是___。
。该做法___(填“合理”或“不合理”),理由是___。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有___(填序号)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
【答案】溶液由棕黄色变成浅绿色 2Fe3++SO2+2H2O=SO![]() +4H++2Fe2+ 0.63 不合理 HNO3可以将SO2氧化成H2SO4,干扰实验 BC
+4H++2Fe2+ 0.63 不合理 HNO3可以将SO2氧化成H2SO4,干扰实验 BC
【解析】
略

【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |
【题目】某兴趣小组为探究温度、压强对可逆反应A(g)+B(g) ![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
A | B | C | |
浓度1 | 0.05 mol·L-1 | a mol·L-1 | 0.05 mol·L-1 |
浓度2 | 0.078 mol·L-1 | 0.078 mol·L-1 | 0.022 mol·L-1 |
浓度3 | 0.06 mol·L-1 | 0.06 mol·L-1 | 0.04 mol·L-1 |
浓度4 | 0.07 mol·L-1 | 0.07 mol·L-1 | 0.098 mol·L-1 |
A. 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强
B. 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应
C. [浓度1]中a=0.05
D. 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差