题目内容
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)可表示为( )
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)可表示为( )
A. υ(NH3)=0.010mol/(L·s)B. υ(O2)=0.0010mol/(L·s)
C. υ(NO)=0.0010mol/(L·s)D. υ(H2O)=0.045mol/(L·s)
【答案】C
【解析】
在体积10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol。则v(H2O)=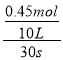 =0.0015molL-1s-1。A、速率之比等于化学计量数之比,所以v(NH3)=
=0.0015molL-1s-1。A、速率之比等于化学计量数之比,所以v(NH3)=![]() ×0.0015molL-1s-1=0.0010molL-1s-1,故A错误;B、速率之比等于化学计量数之比,所以v(O2)=
×0.0015molL-1s-1=0.0010molL-1s-1,故A错误;B、速率之比等于化学计量数之比,所以v(O2)=![]() ×0.0015molL-1s-1=0.00125molL-1s-1,故B错误;C、速率之比等于化学计量数之比,所以v(NO)=
×0.0015molL-1s-1=0.00125molL-1s-1,故B错误;C、速率之比等于化学计量数之比,所以v(NO)=![]() ×0.0015molL-1s-1=0.0010molL-1s-1,故C正确;D、v(H2O)=
×0.0015molL-1s-1=0.0010molL-1s-1,故C正确;D、v(H2O)=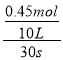 =0.0015molL-1s-1,故D错误;故选C。
=0.0015molL-1s-1,故D错误;故选C。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |
【题目】某兴趣小组为探究温度、压强对可逆反应A(g)+B(g) ![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
A | B | C | |
浓度1 | 0.05 mol·L-1 | a mol·L-1 | 0.05 mol·L-1 |
浓度2 | 0.078 mol·L-1 | 0.078 mol·L-1 | 0.022 mol·L-1 |
浓度3 | 0.06 mol·L-1 | 0.06 mol·L-1 | 0.04 mol·L-1 |
浓度4 | 0.07 mol·L-1 | 0.07 mol·L-1 | 0.098 mol·L-1 |
A. 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强
B. 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应
C. [浓度1]中a=0.05
D. 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内反应的平均反应速率为__;
(2)10s末,生成物D的浓度为__;
(3)若改变下列条件,生成D的速率如何变化(用“增大”“减小”或“不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | ___ |
② | 增大A的浓度 | ___ |
③ | 使用正催化剂 | ___ |
④ | 恒容下充入Ne (不参与体系反应) | ___ |