题目内容
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见右图,电池总反应可表示为:2H2+O2=2H2O。下列有关说法正确的是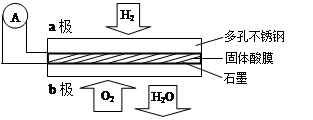
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
D
解析试题分析:根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,标准状况下的体积为1.12L。A、因氢元素的化合价升高,则a为负极,这样电子应该是通过外电路由a极流向b,故A错;B、该电池为酸性电池,反应为O2+4e-+4H+=2H2O,故B错;C、因没有说明是否为标准状况,则气体的体积不一定为1.12L,故C错;D、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故D正确,故选D。
考点:考查燃料电池的工作原理

如图,有关零排放车载燃料电池叙述正确的是( )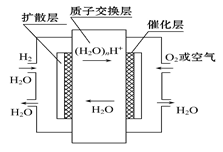
| A.正极通入H2,发生还原反应 |
| B.负极通入H2,发生还原反应 |
| C.导电离子为质子,且在电池内部由正极定向移向负极 |
| D.总反应式为2H2+O2 = 2H2O |
下列关于铜电极的叙述不正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼铜时粗铜作阳极 |
| C.在镀件上镀铜时可用铜作阳极 |
| D.电解稀H2SO4制H2、O2时铜做阳极 |
有如图装置,下列有关该装置反应开始时的叙述正确的是: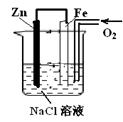
| A.锌极附近滴入酚酞,溶液呈红色。 |
| B.铁极发生的电极反应为:2H2O+O2+4e=4OH- |
| C.铁极发生吸氧腐蚀生成锈蚀 |
| D.溶液中的OH-离子向铁极移动 |
镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+ H2O + 2e-= Cl-+ 2OH-,关于该电池的叙述正确的是
| A.该电池中镁为负极,发生还原反应 |
| B.电池工作时,OH-向正极移动 |
| C.电池工作时,正极周围溶液的pH将不断变小 |
| D.该电池的总反应为:Mg + ClO-+ H2O = Mg(OH)2↓+ Cl- |
图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是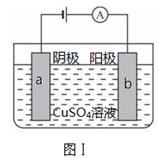

| A.图Ⅰ中a为纯铜 |
| B.图Ⅰ中SO42-向b极移动 |
| C.图Ⅱ中如果a、b间连接电源,则a连接负极 |
| D.图Ⅱ中如果a、b间用导线连接,则X可以是铜 |
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH--14e-=2CO32-+12H2O。有关此电池的推断不正确的是
| A.通入氧气的电极为正极 |
| B.参加反应的O2与C2H6的物质的量之比为7∶2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.放电一段时间后,正极区附近溶液的pH减小 |
银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,放电时它的正、负两极的电极反应式如下:
Ag2O+H2O+2e-=2Ag+2OH-,Zn+2OH--2e-=Zn(OH)2。
下列判断正确的是( )
| A.锌为负极,氧化银为正极 |
| B.锌为正极,氧化银为负极 |
| C.原电池工作时,负极区溶液pH增大 |
| D.原电池反应的化学方程式为Zn+Ag2O+H2O=Zn(OH)2+2Ag |
