题目内容
镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+ H2O + 2e-= Cl-+ 2OH-,关于该电池的叙述正确的是
| A.该电池中镁为负极,发生还原反应 |
| B.电池工作时,OH-向正极移动 |
| C.电池工作时,正极周围溶液的pH将不断变小 |
| D.该电池的总反应为:Mg + ClO-+ H2O = Mg(OH)2↓+ Cl- |
D
解析试题分析:A.该电池中镁为负极,发生氧化反应.Mg-2e-+ 2OH-= Mg(OH)2↓。错误. B.根据同种电荷相互排斥,异种电荷相互吸引的原则,在电池工作时,OH-向正电荷较多的负极移动。错误。C.在电池工作时,由于正极发生反应为:ClO-+ H2O + 2e-= Cl-+ 2OH-,所以正极周围溶液的pH将不断变大。错误。D.根据正极、负极的电极反应式可知该电池的总反应为:Mg + ClO-+ H2O = Mg(OH)2↓+ Cl-。正确。
考点:考查原电池的工作原理的知识。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见右图,电池总反应可表示为:2H2+O2=2H2O。下列有关说法正确的是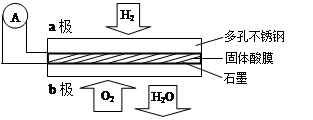
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
下列关于铜电极的叙述,不正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼粗铜时,粗铜作阳极 |
| C.在镀件上电镀铜时可用金属铜作阳极 |
| D.电解稀硫酸制H2、O2时,铜作阳极 |
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO 等离子,电极为惰性电极。下列叙述中正确的是
等离子,电极为惰性电极。下列叙述中正确的是
| A.A膜是阳离子交换膜 |
| B.通电后,海水中阴离子往b电极处运动 |
| C.通电后,b电极上产生无色气体,溶液中出现白色沉淀 |
| D.通电后,a电极的电极反应式为:4OH--4e- = O2↑+2H2O |
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论叙述正确的是
| 选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
| A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
| B | Cu | Zn | 稀H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
| C | C | C | FeCl3 | KI、淀粉混 合液 | b极附近溶液变蓝 |
| D | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3H2OAl2O3+3H2↑电解过程中,以下判断正确的是:
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
| D |  | 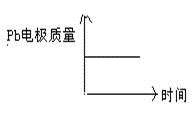 |
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |