题目内容
【题目】用CO合成甲醇的化学方程式为:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
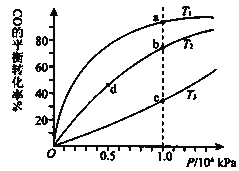
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
【答案】C
【解析】
A. 反应是放热反应,同一压强下,从c点到a点,CO转化率增大,反应正向移动,说明是降温过程,因此T3>T2>T1,故A错误;
B. b、d两点的温度相同,但b点的压强大于d点,故υ(b)> υ(d),a、c两点的压强相同,根据A选项的分析得到c点的温度高,则υ(a)<υ (c),故B错误;
C. 该反应的正反应为放热反应,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,根据A选项得到T3>T2>T1,b、d温度相同,所以平衡常数相同,即K(b)=K(d);温度T3>T1,温度越高,该反应的平衡常数越小,所以K(a)>K(c),故C正确;
D. CO转化率的越大,n(总)越小,由![]() 可知,a、c点中a点n(总)小,则M(a) > M(c),b、d点中b点n(总)小,M(b)>M(d),故D错误。
可知,a、c点中a点n(总)小,则M(a) > M(c),b、d点中b点n(总)小,M(b)>M(d),故D错误。
综上所述,答案为C。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】(Ⅰ)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为___;
H2(g)+I2(g)的平衡常数K2为___;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)C(H2)=c(CO)c(H2O),判断此时温度为___℃。