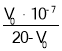题目内容
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为_______________ 。
(2)生产农药的原料 PSCl3 中 P、S、Cl 的第一电离能由大到小的顺序为____电负性由大到小的顺序为__________________________。
(3)H2SO4为粘稠状 难挥发性的酸 ,而 HNO3 是易挥发的酸,其原因是__________
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为________,所含共价 键的类型为_____________,N2O与CO2互为等电子体 ,且N2O 分子中O只与一个N相连,则N2O的电子式为_______________ 。
(5)AlP 因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

①磷化铝的晶体类型为 _____________________ 。
②A、B 点的原子坐标如图所示,则C点的原子坐标为 __________________ 。
③磷化铝的晶胞参数a = 546.35 pm(l pm=10—12 m), 其密度为________g/cm3( 列出计算式即可,用NA表示阿伏加德罗常数的数值)。
【答案】4s24p3 Cl>P>S Cl>S>P H2SO4分子之间易形成氢键,分子间作用力增强,故难挥发;而HNO3易形成分子内氢键,造成分子间作用力减弱,易挥发 sp σ键和π键 ![]() 原子晶体 (1/4,1/4,3/4)
原子晶体 (1/4,1/4,3/4) ![]()
【解析】
(1)As是33号元素,处于周期表中第四周期第VA族,其4s、4p能级上的电子为其价电子;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,As元素原子4p能级为半充满稳定状态,第一电离能高于同周期相邻元素的;同周期主族元素自左而右电负性增大;
(3)根据分子间氢键和分子内氢键推理得出;
(4)COS(羰基硫)中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化类型,共价双键中含有1个σ键、1个π键;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N、N原子之间存在共价双键;
(5)①AlP熔点高,原子之间形成空间立体网状结构;
②白色球C周围的黑色球形成正四面体结构,白色球处于正四面体体心,顶点黑色球与C的连线处于晶胞体对角线上,由几何知识计算C的坐标;
③利用公式晶胞密度![]() 计算;
计算;
(1)As是33号元素,处于周期表中第四周期第VA族,其4s、4p能级上的电子为其价电子,其价电子排布式为4s24p3,
故答案为:4s24p3;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,As元素原子4p能级为半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能为:Cl>P>S.同周期主族元素自左而右电负性增大,故电负性:Cl>S>P,
故答案为:Cl>P>S;Cl>S>P;
(3) H2SO4分子之间易形成氢键,分子间作用力增强,故难挥发;而HNO3易形成分子内氢键,造成分子间作用力减弱,易挥发,
故答案为:H2SO4分子之间易形成氢键,分子间作用力增强,故难挥发;而HNO3易形成分子内氢键,造成分子间作用力减弱,易挥发;
(4)COS(羰基硫)结构式为O=C=S,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化类型为sp,共价双键中含有1个σ键、1个π键,所以该分子中含有σ键和π键;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N、N原子之间存在共价双键,其电子式为![]() ,
,
故答案为:sp;σ键和π键;![]() ;
;
(5)①AlP熔点高,原子之间形成空间立体网状结构,属于原子晶体,
故答案为:原子晶体;
②白色球C周围的黑色球形成正四面体结构,白色球处于正四面体体心,顶点黑色球与C的连线处于晶胞体对角线上,由几何知识可知二者连线等于晶胞体对角线长度的![]() ,C到左侧平面距离等于晶胞棱长的
,C到左侧平面距离等于晶胞棱长的![]() ,即参数x的值,C到前平面距离等于晶胞棱长的
,即参数x的值,C到前平面距离等于晶胞棱长的![]() ,即参数y的值,C到下底面距离等于晶胞棱长的
,即参数y的值,C到下底面距离等于晶胞棱长的![]() ,即参数z的值,故C点的原子坐标为(
,即参数z的值,故C点的原子坐标为(![]() ,
,![]() ,
,![]() ),
),
故答案为:(1,14,34);
③该晶胞中P原子个数![]() 、Al原子个数为4,晶胞体积a3,晶胞密度
、Al原子个数为4,晶胞体积a3,晶胞密度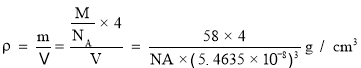 ,
,
故答案为:![]() 。
。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
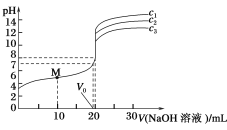
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸___。
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2___(选填“是”或“否”).混合液中离子浓度c(A-)与c(Na+)的大小关系是___。
(3)丙组实验结果分析,HA是___酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=___molL-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)
c(Na+)-c(A-)=__molL-1
c(OH-)-c(HA)=__molL-1