题目内容
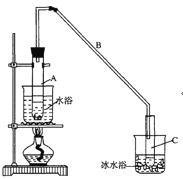
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: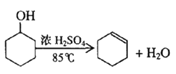

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是___________。
②试管C置于冰水浴中的目的是_____________。
(2)制备精品
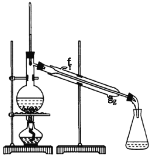
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(_______)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
【答案】防暴沸 冷凝 防止环己烯挥发 上 c 干燥 83℃ c bc
【解析】
(1)①为了防止液体暴沸,实验时需要加入碎瓷片防止暴沸;导管B除了导气外还具有冷凝作用;
②环己烯的沸点为83℃,易挥发;
(2)①环己烯不溶于水,且密度比水小;分液后环己烯粗品中还含有少量的酸和环己醇;
②生石灰能与水反应生成氢氧化钙;
③环己烯的沸点为83℃;环己烯的精品质量偏低,说明粗产品中其他的杂质多;
(3)粗产品和精品的区别在于粗产品中含有环己醇,而精品中没有。
(1)①由方程式可知该反应为液液加热的反应,为了防止液体暴沸,实验时需要加入碎瓷片防止暴沸;由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝,故答案为:防暴沸;冷凝;
②由于生成的环己烯的沸点为83℃,易挥发,将收集环己烯的试管置于冰水浴中,可以防止环己烯挥发,故答案为:防止环己烯挥发;
(2)①环己烯不溶于水,且密度比水小,振荡、静置、分层后环己烯在上层;由于分液后环己烯粗品中还含有少量的酸和环己醇,用Na2CO3溶液洗涤可除去酸、吸收醇;不能用酸性高锰酸钾,否则会氧化环己烯,故答案为:上;c;
②生石灰能与水反应生成氢氧化钙,除去了环己烯中残留的水起到干燥作用,蒸馏时得到纯净的环己烯,故答案为:干燥;
③环己烯的沸点为83℃,所以收集产品时,控制的温度应在83℃;环己烯的精品质量偏低,说明粗产品中其他的杂质多,所以可能是制备粗产品时环己醇一同被蒸出,故答案为:83℃;c;
(3)粗产品和精品的区别在于粗产品中含有环己醇,而精品中没有,酸性高锰酸钾溶液具有强氧化性,能氧化环己醇和环己烯,不能区分环己烯精品和粗品;钠和醇反应,与环己烯不反应。可以区分环己烯精品和粗品;环己醇的沸点和环己烯的沸点差别较大,测定沸点c也可以区分,故答案为:bc。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。