题目内容
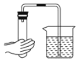
【题目】用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项( )

选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
A | 碱 | 酸 | 石蕊 | 乙 |
B | 酸 | 碱 | 酚酞 | 甲 |
C | 碱 | 酸 | 甲基橙 | 乙 |
D | 酸 | 碱 | 酚酞 | 乙 |
A. A B. B C. C D. D
【答案】D
【解析】
酸碱中和滴定时,酸液应盛装在酸式滴定管中,碱液应盛装在碱式滴定管中,酸碱指示剂一般不能用石蕊,其变色范围大,会引起较大误差。
A项、不能用碱式滴定管盛装酸性溶液,不能用石蕊做指示剂,故A错误;
B项、不能用酸式滴定管盛装碱性溶液,故B错误;
C项、不能用碱式滴定管盛装酸性溶液,故C错误;
D项、用酚酞做指示剂,到达滴定终点时,溶液颜色由无色变为浅红色,并且滴定管使用正确,故D正确。
故选D。

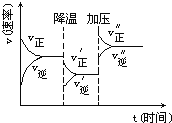
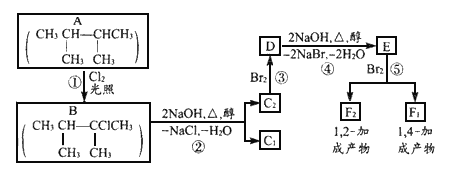
【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。