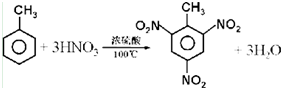
题目内容
12.氮元素能形成多种多样的化合物.请回答:(1)298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
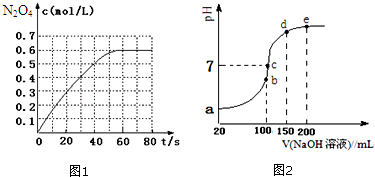
①298k时,该反应的平衡常数为6.67L•mol-1(精确到0.01);
②下列情况不能用来判断该反应是否处于平衡状态的是A;
A.混合气体的密度保持不变; B.混合气体的颜色不再变化;C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正)<v(逆)(填“>”、“<”或“=”).
(2)常温条件下,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的).
①a点溶液的pH<1(填“>”“<”或“=”);
②b点溶液中发生水解反应的离子是NH4+;
③c点溶液中各离子浓度由大到小的排列顺序为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
④d、e点对应溶液中,水电离程度大小关系是d>e(填“>”、“<”或“=”).
分析 (1)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,带入平衡常数表达式计算;
②A.气体的质量不变,容积恒定,因此气体的密度为一定值;
B.混合气体的颜色不变,说明NO2的浓度保持恒定;
C.反应2NO2(g)?N2O4(g)气压恒定时,正、逆反应速率相等;
③反应为放热反应,升高温度,K值减小,计算可知此时的浓度商Q=K(298K)>K(398K),反应向逆反应方向移动,因此V(正)<V(逆);
(2)①常温条件下,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,硫酸氢铵溶液显酸性,铵根离子水解显酸性;
②a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;
③c点溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分;
④根据碱性溶液中,氢氧根离子浓度越大,水的电离程度越小进行分析.
解答 解:(1)①有图可知N2O4的平衡浓度为0.6mol/L,达到平衡时,N2O4的浓度为NO2的2倍,则NO2的平衡浓度为0.3mol/L,则K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.6}{0.{3}^{2}}$=6.67,
故答案为:6.67;
②A.反应物和生成物全是气态物质,气体的质量不变,容积为2L保持恒定,由ρ=$\frac{m}{V}$可知气体的密度为一定值,因此气体的密度保持不变不一定处于平衡状态,故A正确;
B.混合气体的颜色不变说明NO2的浓度不变,说明反应处于化学平衡状态,故B错误;
C.反应2NO2(g)?N2O4(g)是一个气体体积减小的反应,气压恒定时,正、逆反应速率相等,说明反应处于化学平衡状态,故C错误;
故答案为:A;
③反应为放热反应,升高温度,K值减小,密闭容器的体积为2L,因此的N2O4的浓度为0.6mol/L,NO2的浓度为0.3mol/L,浓度商Q=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.6}{0.{3}^{2}}$=6.67=K(298K)>K(398K),反应向逆反应方向移动,故:V(正)<V(逆),
故答案为:<;
(2)①硫酸氢铵溶液显酸性,铵根离子水解显酸性,0.1mol•L-1NH4HSO4溶液中 氢离子浓度大于0.1mol/L,溶液PH<1,
故答案为:<;
②a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,溶液中发生水解反应的离子是NH4+,故答案为:NH4+;
③c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),c点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
④d、e溶液都为碱性溶液,溶液中的氢氧根离子抑制了水的电离,则氢氧化钠溶液体积越大,水的电离沉淀越小,故d点水的电离程度大于e点水的电离,
故答案为:>.
点评 本题考查平衡常数的计算、平衡的移动、离子浓度大小比较、盐类水解等知识点,题目难度中等,试题知识点较多,综合性较强,充分考查了学生的分析、理解能力;离子浓度大小比较常与盐类水解、弱电解质的电离联合考查,确定离子浓度大小时要结合电荷守恒、物料守恒来分析解答.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案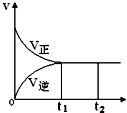 可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )
可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )| A. | t1~t2,各物质的浓度不再发生变化 | |
| B. | t2时刻升高温度,反应物转化率不会改变 | |
| C. | t2时刻增大N2的浓度,可提高H2的转化率 | |
| D. | 使用催化剂可加快反应速率,提高生产效率 |
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-+3H2O═2[Al(OH)4]- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| D. | 用食醋除去水瓶中的水垢:CO${\;}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O |
| A. | AgNO3 溶液中加入Cu:Cu+Ag+=Cu2++Ag | |
| B. | NaHCO3溶液中加入CH3COOH:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O | |
| C. | 含0.2mol FeBr2 的溶液中通入0.2mol Cl2:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| A. | 化合反应和分解反应一定是氧化还原反应 | |
| B. | CO2+H2O=H2CO3 是化合反应但不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应,复分解反应不可能属于氧化还原反应 | |
| D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 不是置换反应但是氧化还原反应 |
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 饱和NaCl溶液中通入HCl气体有晶体析出 | |
| C. | 500℃左右比室温更有利于合成氨反应 | |
| D. | 滴有酚酞试液的氨水中加入少量醋酸铵晶体,溶液红色变浅 |
| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |