题目内容
【题目】广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中稳定。
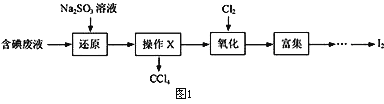
Ⅰ.工业上制备连二亚硫酸钠的流程如下:

请回答下列问题:
(1)步骤①中的化学方程式为___________________________________;
(2)步骤②中沉淀为_________________________________(填化学式);
(3)步骤③中加入NaCl 固体的作用是______________________________,分离出保险粉方法为_______、洗涤、干燥,洗涤所用试剂是___________________________。
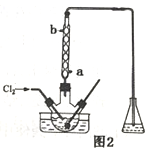
Ⅱ.工业上也可用右图装置电解NaHSO3溶液制Na2S2O4。
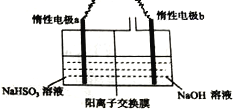
(1)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________________;
(2)若不加隔膜,则得不到连二亚硫酸钠,其原因是____________________________。
Ⅲ.探究Na2S2O4的性质:
某课题小组常温下测定0.050 molL-1Na2S2O4溶液在空气中的pH变化如下图所示;
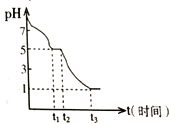
(1)0-t1段主要生成HSO3-,根据pH变化图,写出0- t1发生反应的离子方程式为______________;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32-)-c(H2SO3) =__________ molL-1(填具体数值,不考虑溶液体积变化)
【答案】 Zn+2SO2=ZnS2O4 Zn(OH)2 降低Na2S2O4的溶解度,使更多Na2S2O4析出 过滤 乙醇 负极 2HSO3-+2e-=S2O42-+2OH- Na2S2O4被阳极生成的氧气氧化或HSO3-在阳极失电子得到硫酸根 2H2O+2S2O42-+O2=4HSO3- 10-5-10-9
【解析】Ⅰ.锌粉加水形成分散系,再通入二氧化硫反应得到ZnS2O4,加入18%d NaOH溶液反应得到氢氧化锌沉淀、Na2S2O4,最后加入NaCl降低Na2S2O4的溶解度,析出Na2S2O4,溶液D中含有NaCl。
(1)根据上述分析,步骤①中的化学方程式为Zn+2SO2=ZnS2O4,故答案为:Zn+2SO2=ZnS2O4;
(2)步骤②中沉淀为Zn(OH)2,故答案为:Zn(OH)2;
(3)步骤③中加入NaCl 固体可以降低Na2S2O4的溶解度,使更多Na2S2O4析出,然后过滤、洗涤、干燥即可分离出保险粉;连二亚硫酸钠(Na2S2O4)是一种强还原剂,可溶于水,但不溶于乙醇。为了减少Na2S2O4的溶解损失,洗涤液可以选用乙醇,故答案为:降低Na2S2O4的溶解度,使更多Na2S2O4析出;过滤;乙醇;
Ⅱ. a极上NaHSO3生成Na2S2O4,S元素化合价由+4价降低到+3价,发生还原反应,应为阴极,a连接电源的负极,b极上氢氧化钠溶液中的水被氧化生成氧气,为阳极,b连接电源的正极。
(1)根据上述分析,惰性电极a连接电源的负极”),其电极反应式为2HSO3-+2e-=S2O42-+2OH-,故答案为:负极;2HSO3-+2e-=S2O42-+2OH-;
(2)若不加隔膜,Na2S2O4被阳极生成的氧气氧化得到硫酸根,得不到连二亚硫酸钠,故答案为:Na2S2O4被阳极生成的氧气氧化得到硫酸根;
Ⅲ.(1)Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为 2S2O42-+O2+2H2O=4HSO3-,故答案为:2S2O42-+O2+2H2O=4HSO3-;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,浓度为0.1 mol/L,根据图像,此时溶液的pH=5,溶液中存在物料守恒,c(SO32-)+c(H2SO3)+ c(HSO3-)=0.1 mol/L,也存在电荷守恒,c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-),则c(SO32-)-c(H2SO3)= c(Na+)+ c(H+)- c(OH-)-0.1 mol/L= c(H+)- c(OH-)=(10-5-10-9)mol/L,故答案为:10-5-10-9。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案