题目内容
硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
① Na2SO4+ 4C→ Na2S+ 4CO↑ ② Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。
(1)0.2(2分)
(2)66.3%(2分)
(3)①0.5 1.0(2分) ② 2:3(3分)
(4)24g(5分,列式3分,计算过程及结果2分)
解析试题分析:(1)要制取Na2S 15.6 g,需原料芒硝。根据硫原子守恒可知,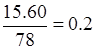 ,解得(Na2SO4·10H2O)0.2mol。
,解得(Na2SO4·10H2O)0.2mol。
(2)根据两步转化关系通过计算求得Na2S的纯度为 66.3%。
(3)①由反应①和②可得反应③:Na2SO4+ 2C Na2S + 2CO2↑根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:0.5 mol ~ 1 mol。②若在上述过程中生成Na2S的质量为62.4 g,即为0.8mol。设混合气体中CO和CO2的物质的量分别是x,a。则有
Na2S + 2CO2↑根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:0.5 mol ~ 1 mol。②若在上述过程中生成Na2S的质量为62.4 g,即为0.8mol。设混合气体中CO和CO2的物质的量分别是x,a。则有
①: Na2SO4+ 4C Na2S + 4CO
Na2S + 4CO
x mol x/4 mol x mol
根据反应③: Na2SO4+ 2C  Na2S + 2CO2
Na2S + 2CO2
a mol a/2 mol a mol
根据题意得: a mol + x mol ="2" mol
a/2mol + x/4 mol =" 0.8" mol,解得:a=1.2,x-0.8,则CO和CO2的体积比为3:2。
(4)5.62 g沉淀是硫酸钡和硫, 1.12 LH2S气体物质的量是0.05mol。设硫的物质的量为amol,硫酸钠的物质的量为bmol,则根据下列两个方程式可建立关系式:
2Na2S+ Na2SO3+6 HCl="6NaCl+" 3S↓+3H2O
2a/3 a/3 a
Na2S+ 2HCl= NaCl+H2S
0.05mol 0.05mol
233b+32a=5.62;再根据质量守恒:25.76 = a/3(126*2)+322b+(0.05+2a/3)*78,再根据硫原子守恒,求出原硫化钠晶体的质量24g。
考点:本题考查根据化学方程式进行计算。

 阅读快车系列答案
阅读快车系列答案