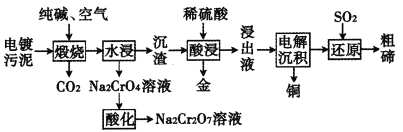
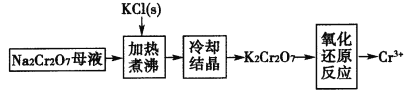
题目内容
【题目】实验室里也可以利用以下反应制取少量氯气:2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
A.KMnO4中的锰元素被氧化
B.Cl2既是氧化产物,又是还原产物
C.HCl在反应中只做还原剂
D.每生成1molCl2转移电子的物质的量为2mol
【答案】D
【解析】
A.KMnO4中的锰元素化合价降低,得到电子,被还原,故A错误;
B.Cl2是由HCl失电子得来的,是氧化产物,不是还原产物,故B错误;
C.HCl在反应中一部分价态升高,一部分价态不变,表现出还原性和酸性,故C错误;
D.由2HCl~Cl2~2e-可知,每生成1molCl2转移电子的物质的量为2mol,故D正确;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×101 | 1.7×105 | 6.2×1010 | K1=4.3×107 K2=5.6×1011 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。
(3)常温下,0.1 mol·L1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH]
C.[H+]·[OH] D.[OH]/[H+]
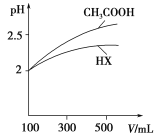
(4)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
【题目】某研究性学习小组的同学在学习了二氧化碳与过氧化钠的反应后,对过氧化钠与二氧化硫的反应进行实验探究。
(1)提出假设:
假设1. 固体产物是Na2SO3
假设2. _________________________
假设3. 固体产物是Na2SO3和Na2SO4的混合物。
(2)实验验证:用如图所示装置对上述假设进行实验。
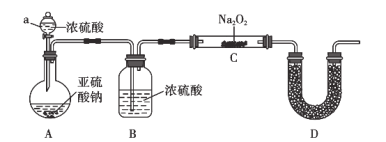
(1)仪器a的名称为__________,装置A中发生反应的化学方程式为:________________________。
(2)装置B的作用为________________________,装置D中试剂的名称为________。
(3)装置C中固体完全反应后,得到白色固体,进行如下实验。
实验操作 | 预期现象与结论 |
步骤1.取少量白色固体于试管中,加入足量的稀盐酸,将生成的气体通入品红溶液。 | 若_____________,说明白色固体中含有Na2SO3。 |
步骤2.在步骤1反应后的溶液中加入________ | 若_____________,说明白色固体中含有Na2SO4。 |
通过实验探究发现上述两个实验现象均有,则说明假设3正确。