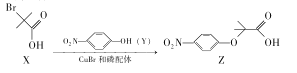
题目内容
【题目】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
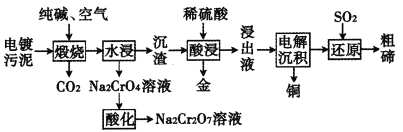
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2。
2CuO+TeO2。
(1)Te元素在元素周期表中的位置为______________其基态原子的电子占据的最高能层符号为________。
(2)煅烧时,Cr2O3发生反应的化学方程式为__________________。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有________(填化学式)。电解沉积过程中析出单质铜的电极为_________极。
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
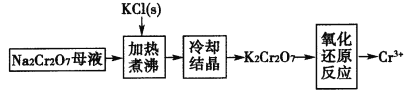
通过冷却结晶能析出大量K2Cr2O7的原因是______________。
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.50 g配成250 mL溶液,取25.00 mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000 mol·L-1(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为____________________。
若三次实验消耗(NH4)2Fe(SO4)2标准液的体积平均为25.00 mL,则所得产品中K2Cr2O7的纯度为________%(保留三位有效数字)。
【答案】第五周期ⅥA族 O 2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2 CuSO4 阴 低温条件下,K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 49.0
4Na2CrO4+4CO2 CuSO4 阴 低温条件下,K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 49.0
【解析】
某种电镀污泥中主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜、粗碲等,根据流程图,煅烧时Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2,Cr2O3与纯碱和空气中的氧气反应生成Na2CrO4,Na2CrO4酸化后生成Na2Cr2O7溶液;沉渣中主要含有CuO、TeO2以及少量的金(Au),用稀硫酸溶解后,浸出液中主要含有铜离子和TeOSO4,电解后铜离子放电生成铜,溶液中含有TeOSO4,TeOSO4与二氧化硫发生氧化还原反应生成粗碲,据此分析解答。
2CuO+TeO2,Cr2O3与纯碱和空气中的氧气反应生成Na2CrO4,Na2CrO4酸化后生成Na2Cr2O7溶液;沉渣中主要含有CuO、TeO2以及少量的金(Au),用稀硫酸溶解后,浸出液中主要含有铜离子和TeOSO4,电解后铜离子放电生成铜,溶液中含有TeOSO4,TeOSO4与二氧化硫发生氧化还原反应生成粗碲,据此分析解答。
(1)Te是52号元素,原子核外电子排布为2、8、18、18、6,可见Te元素在元素周期表中的位置为第五周期第VIA族,最高能层为第5能层,故其基态原子的电子占据的最高能层符号为O;
(2)煅烧时,Cr2O3与O2及Na2CO3发生反应产生Na2CrO4和CO2,反应的化学方程式为:2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2;
4Na2CrO4+4CO2;
(3)根据上述分析,浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有CuSO4,Cu2+转化为铜单质,发生还原反应,电解沉积过程中析出单质铜的电极为阴极;
(4)在低温条件下K2Cr2O7的溶解度在整个体系中最小,且K2Cr2O7的溶解度随温度的降低而显著减小,因此通过冷却结晶能析出大量K2Cr2O7;
(5)氧化还原滴定过程中发生Fe2+与Cr2O72-的反应,其中Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
反应中消耗Fe2+的物质的量n(Fe2+)=c·V=0.1000 mol·L-1×0.025 L=0.0025 mol,根据方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知n(Cr2O72-)=![]() n(Fe2+)=
n(Fe2+)=![]() mol,则所得样品中K2Cr2O7的纯度=
mol,则所得样品中K2Cr2O7的纯度=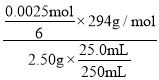 ×100%=49.0%。
×100%=49.0%。