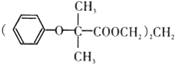
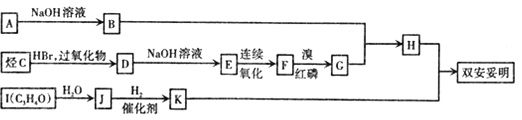
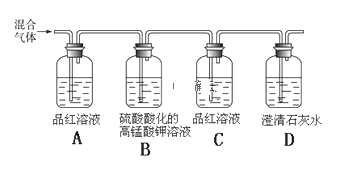
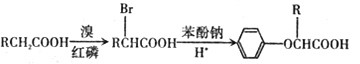题目内容
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. X和Y的转化率相等
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的ΔH>0
【答案】A
【解析】
2X(g)+Y(g)![]() Z(g)
Z(g)
初始:1 1
反应:0.6 0.3 0.3
平衡:0.4 0.7 0.3
A.以X浓度变化表示的反应速率=0.6mol/(10L×60s)=0.0001mol·L-1·s-1,A正确;
B.X的转化率为60%,Y的转化率为30%,不相等,B错误;
C.若增大压强,体积减小,平衡正向移动,则物质Y的转化率增大,C错误;
D.若升高温度,X的体积分数增大,平衡逆向移动,则逆反应方向为吸热,该反应的正反应为放热反应,ΔH<0,D错误;
答案为A。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
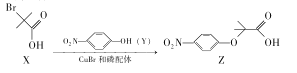
浙江之星课时优化作业系列答案【题目】乙二醇是工业常见的有机原料,常用来制取纺织工业的乙二醛和化妆品行业的乙醛酸。
①乙二醇(HOCH2CH2OH)气相催化氧化法制取乙二醛(OHC-CHO),主要反应为:HOCH2CH2OH(g)+O2(g)![]() OHC—CHO(g)+2H2O(g) H
OHC—CHO(g)+2H2O(g) H
化学键 | O—H | C—H | C—O | C=O | O=O | C—C |
键能(kJ·mol-1) | 436 | 413 | 356 | 745 | 493 | 346 |
则H=_____kJ·mol-1。
②当原料气中氧醇比(氧气和乙二醇的物质的量之比)一定时,乙二醛和副产物CO2的产率与反应温度的关系如图所示,则反应中应控制的适宜温度是___(填字母)。
a.低于450℃
b.450℃~490℃
c.高于495℃
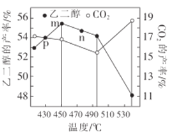
p、m、n三点中____是平衡点,__是逆反应速率最快的点。
③温度超过495℃时,乙二醛的产率直线下降的原因是___。
(2)将乙二醇氧化为乙二酸,再利用乙二酸(HOOCCOOH)通过电解制备乙醛酸,阴极的电极反应式为____。
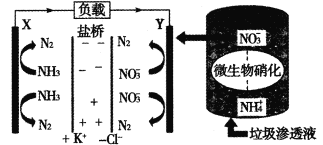
(3)液相氧化制备乙醛酸是近年研究的热点。向25L某浓度的乙二醛溶液中,加入适量的催化剂V2O5/C,以0.1mol·L-1的流速通入氧气,测得溶液中乙二醛的浓度、溶液的pH随时间变化的关系如图所示:
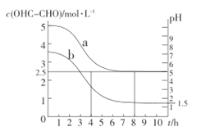
①图中曲线___(填“a”或“b”)表示溶液的pH值随时间变化的曲线。
②V2O5/C表示将催化剂覆盖在纳米碳纤维上,其目的是___。
③写出制备乙醛酸(HOC—COOH)的化学反应方程式:____,根据图中数据算出8h内乙醛酸的平均生成速率v(HOC—COOH)=____;该实验条件下乙醛酸的电离常数Ka=___。