题目内容
14.有四种物质是①6gH2,②0.1molCO2,③1.204×1024个氯化氢分子,④147g硫酸,它们的物质的量最大的是①(填序号,下同),所含分子数最多的是①,含有原子个数最多的是④,质量最大的是④.分析 先根据物质的量与其它物理量之间的转化关系,将选项中的各量转化成物质的量,根据N=n×NA可知物质的量越大,含有的分子数越多;原子的物质的量越大,含有的原子数越多,再根据m=n×M进行计算.
解答 解:①6gH2的物质的量为:$\frac{6g}{2g/mol}$=3mol,n(原子)=3×2=6mol,m=6g,
②0.1molCO2的物质的量为:0.1mol,n(原子)=0.1×3=0.3mol,m=0.1×44=4.4g,
③1.204×1024个HCl的物质的量为:2mol,n(原子)=2×2=4mol,m=2×36.5=73g,
④147gH2SO4的物质的量为:$\frac{147g}{98g/mol}$=1.5mol,n(原子)=1.5×7=10.5mol,m=147g,
物质的量最大的是①,故含有分子数最多的就是①,原子的物质的量最大的是④,故含有原子数最多的就是④,质量最大的是④,
故答案为:①;①;④;④.
点评 本题考查物质的量有关计算、微粒数目计算、阿伏伽德罗定律及其推论,明确基本公式是解本题关键,注意根据PV=nRT理解阿伏伽德罗定律及其推论,题目难度不大.

练习册系列答案
相关题目
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 向FeBr2溶液中通入足量 Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向50 mL 1 mol•L-1明矾溶液中滴入两滴0.1 mol•L-1Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
2. 1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,Na、Mg、Al第一电离能I1从小到大的排列顺序是Na、Al、Mg.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是水分子间有氢键发生缔合作用.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的分子有CCl4(SiCl4)等(任写一种).
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有AC(填序号).
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
④写出基态Cu原子的外围电子排布式3d104s1;金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是$\frac{4M}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$g/cm3(列出计算式).
 1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是水分子间有氢键发生缔合作用.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的分子有CCl4(SiCl4)等(任写一种).
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有AC(填序号).
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
④写出基态Cu原子的外围电子排布式3d104s1;金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是$\frac{4M}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$g/cm3(列出计算式).
19.由C5H10、C2H4O2、C3H6O2和C6H12O6组成的混合物,经测定含氧元素的质量分数为x,则此混合物中含碳元素的质量分数为( )
| A. | $\frac{6(1-x)}{7}$ | B. | $\frac{1-x}{7}$ | C. | $\frac{3x}{4}$ | D. | 无法计算 |
6.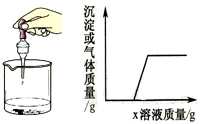 向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )
向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )
 向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )
向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )| 序号 | 烧杯中的物质 | x溶液 |
| A | 生锈的铁钉 | 稀HCl |
| B | 盐酸与稀硫酸 | BaCl2溶液 |
| C | 镁铝合金 | NaOH溶液 |
| D | AlCl3和MgCl2溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
 如图为人体在某项生理过程中所发生的化学反应示意图.
如图为人体在某项生理过程中所发生的化学反应示意图.