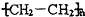题目内容
6. 向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )
向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )| 序号 | 烧杯中的物质 | x溶液 |
| A | 生锈的铁钉 | 稀HCl |
| B | 盐酸与稀硫酸 | BaCl2溶液 |
| C | 镁铝合金 | NaOH溶液 |
| D | AlCl3和MgCl2溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.先发生氧化铁与盐酸的反应,再发生Fe与盐酸的反应生成氢气;
B.开始发生硫酸根离子与钡离子的反应;
C.开始发生Al与NaOH溶液的反应;
D.开始发生生成氢氧化镁和氢氧化铝沉淀的反应,至沉淀最多后氢氧化铝溶解.
解答 解:A.先发生氧化铁与盐酸的反应,再发生Fe与盐酸的反应生成氢气,则开始无气体,然后生成气体至最多,故A正确;
B.开始发生硫酸根离子与钡离子的反应,则图象中开始就生成沉淀,与图象不符,故B错误;
C.开始发生Al与NaOH溶液的反应,则图象中开始就生成气体,与图象不符,故C错误;
D.开始发生生成氢氧化镁和氢氧化铝沉淀的反应,至沉淀最多后氢氧化铝溶解,则开始就生成沉淀,然后沉淀减少一定量不再变化,与图象不符,故D错误;
故选A.
点评 本题考查实验装置的综合应用,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意图象与反应的对应关系,题目难度不大.

练习册系列答案
相关题目
16.下列各组物质的性质比较中,正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | B. | 溶解度:Na2CO3<NaHCO3 | ||
| C. | 熔点:Rb>K>Na>Li | D. | 还原性:Rb<K<Na<Li |
17.检验某未知溶液中是否含有SO42-,下列操作最合理的是( )
| A. | 加入HNO3酸化的Ba(NO3)2溶液 | |
| B. | 先加入HNO3酸化,再加Ba(NO3)2 | |
| C. | 加入盐酸酸化的BaCl2 | |
| D. | 先用盐酸酸化,若有沉淀,则过滤,滤液中再加BaCl2溶液 |
1.下列物质中最难电离出H+的是( )
| A. | CH3CH2 CH2OH | B. | CH3COOH | C. | H2O | D. | H2CO3 |
11.下列叙述不正确的是( )
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 纤维素乙酸酯、油脂和蛋白质在一定条件下都能水解 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
8. 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183 kJ/moL.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-bkJ•mol-1
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
②若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大D.再充入1molCO和3molH2
③经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L-1、c(H2)=0.4mol•L-1、c(CH3OH)=0.8mol•L-1,则此时v正<v逆(填“>”、“<”或“=”).
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的负极反应式为CH3OH+3O2--6e-═CO2+2H2O.电池工作时,固体电解质里的O2-向负极移动.
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183 kJ/moL.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-bkJ•mol-1
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
②若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大D.再充入1molCO和3molH2
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的负极反应式为CH3OH+3O2--6e-═CO2+2H2O.电池工作时,固体电解质里的O2-向负极移动.
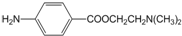 )的三条合成路线如图所示(部分反应试剂和条件已省略):
)的三条合成路线如图所示(部分反应试剂和条件已省略):
 ;C中官能团的名称是氨基和羧基.
;C中官能团的名称是氨基和羧基. ;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.
;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.