题目内容
【题目】将过量的二氧化碳分别通入:①氯化钙溶液 ②硅酸钠溶液 ③氢氧化钙溶液 ④饱和碳酸钠溶液。最终溶液中有白色沉淀析出的是( )
A.①②③④
B.②④
C.①②③
D.②③
【答案】B
【解析】
二氧化碳溶于水:CO2+H2O![]() H2CO3,碳酸的酸性比盐酸弱,比硅酸强。
H2CO3,碳酸的酸性比盐酸弱,比硅酸强。
①二氧化碳通入氯化钙溶液无明显现象,不符合;
②过量的二氧化碳通入硅酸钠溶液中有白色沉淀硅酸生成,符合;
③二氧化碳通入氢氧化钙溶液至过量,Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3+H2O+CO2=Ca(HCO3)2,最终生成碳酸氢钙而无沉淀,不符合;
④过量二氧化碳通入饱和碳酸钠溶液中:Na2CO3+H2O+CO2=2NaHCO3↓,生成的碳酸氢钠溶解度比碳酸钠溶解度小而结晶析出,符合。
答案选B。

【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
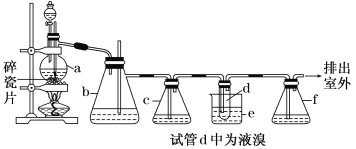
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是______________________。
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是______________________; 但不用冰水进行过度冷却,原因_______________________________________________。