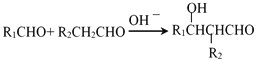题目内容
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。
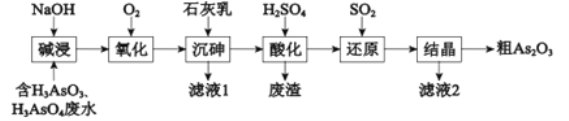
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐.H3AsO4转化为Na3AsO4反应的化学方程式是__________.
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2___________.
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)△H<0
Ca2+(aq)+2OH-(aq)△H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃.高于85℃后,随温度升高,沉淀率________(填“提高”或“下降”)。用化学平衡原理解释其原因是_________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_________.
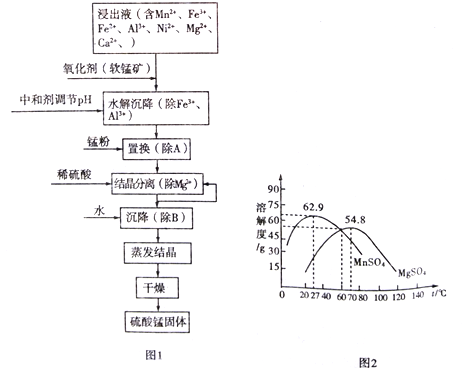
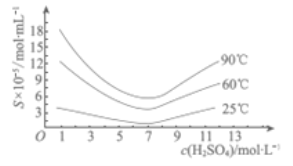
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3.As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示.为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是___________.
(6)下列说法中,正确的是__________(填字母).
a.粗As2O3中含有CaSO4
b.工业生产中,滤液1、2和废渣一同弃掉
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
【答案】 H3AsO4+3OH-═AsO43-+3H2O 0.5 下降 温度升高,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降 H3AsO4+H2O+SO2═H3AsO3+H2SO4 调硫酸浓度约为7mol/L,冷却至25℃,过滤 ac
【解析】(1)H3AsO4与碱反应生成Na3AsO4和水,化学方程式是:H3AsO4+3OH-═AsO43-+3H2O;正确答案:H3AsO4+3OH-═AsO43-+3H2O。
(2)根据电子守恒规律:1molAsO33-转化为AsO43-失电子为2 mol,设氧气为xmol,4x=2,x=0.5mol;正确答案:0.5。
(3) “沉砷”的最佳温度是85℃.高于85℃后,随温度升高,沉淀率会下降;原因温度升高,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降;正确答案:下降;温度升高,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降。
(4)溶液中通入二氧化硫气体,把H3AsO4转化为H3AsO3,二氧化硫被氧化为硫酸根离子,化学方程式是:H3AsO4+H2O+SO2═H3AsO3+H2SO4 ;正确答案: H3AsO4+H2O+SO2═H3AsO3+H2SO4。
(5)根据图像可知,硫酸溶液的浓度为7mol/L时,温度控制在25℃时,As2O3的沉淀率较大;正确答案:调硫酸浓度约为7mol/L,冷却至25℃,过滤。
(6)根据流程可知,“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,酸化时加入硫酸,会有CaSO4生成,所以粗As2O3中含有CaSO4,a正确;滤液1中含有氢氧化钠溶液;滤液2中含有硫酸钠溶液,废渣中含有硫酸钙,这些物质不能随意弃掉,应加以回收利用,b错误;通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的,c正确;正确选项ac。