题目内容
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
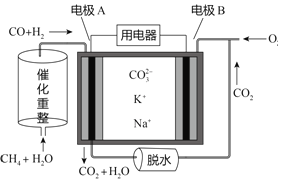
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移8mol电子
3H2+CO,每消耗1molCH4转移8mol电子
B. 电池工作时,CO32-向电极A移动
C. 电极A上只有H2参与电极反应,反应式为H2+2OH--2e-=2H2O
D. 电极B上发生的电极反应为O2+4e-=2O2-
【答案】B
【解析】A.根据C元素的化合价变化结合电子守恒来分析;
B.原电池中阴离子向负极移动;
C.原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水;
D.在原电池的正极上是氧气得电子发生还原反应。
A.CH4→CO,化合价由-4价→+2价,上升6价,则1molCH4参加反应共转移6mol电子,A错误;
B.通氧气的一极为正极,则B为正极,A为负极,原电池中阴离子向负极移动,A为负极,所以CO32-向电极A移动,B正确;
C.通氧气的一极为正极,则B为正极,A为负极,负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,C错误;
D.B电极上氧气得电子发生还原反应O2+2CO2+4e-=2CO32-,D错误。
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 | Ka1=5.9×10-2 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=mol·L-1(填精确计算结果)。
(5)将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为。