题目内容
【题目】软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如下图图1所示。已知金属单质的活动顺序为Al>Mn>Fe>Ni。回答下列问题:
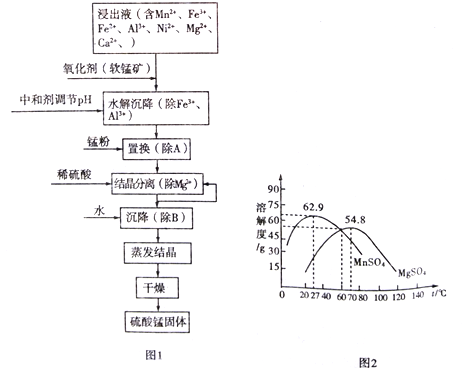
(1)用离子方程式表示加入“氧化剂(软锰矿)”作用:_________________________。
(2)已知:Ksp[Al(OH)3]=1.0×10-33 Ksp[Ni(OH)2]=1.6×10-15
Ksp[Mn(OH)2]=4.0×10-14 Ksp[Fe(OH)3]=2.6×10-39
“水解沉降”中:
①“中和剂”可以是__________(填标号)。
A.Al2O3 B.MgO C.H2SO4 D.MnO2
②溶液的pH应不低于______________。(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)
(3)“置换”的目的是____________________(用离子方程式表示)。
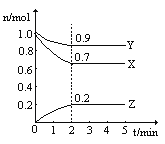
(4)“结晶分离”中的部分物质的溶解度曲线如上图图2所示。结晶与过滤过程中,体系温度均应维持在______________℃(填“27”、“60”或“70”)。
(5)“草酸钠一高锰酸钾返滴法”可测定软锰矿中MnO2的纯度(假设杂质不参与反应):取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1 mol/LNa2C2O4溶液(足量),最后用c2mol/L的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为________________________。
②该样品中MnO2的质量分数为______(假定杂质不参与反应,列出表达式即可)。
【答案】 MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O B 5 Mn+Ni2+═Mn2++Ni 70 MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O ![]()
【解析】(1). “氧化剂”发生反应是利用二氧化锰将亚铁离子氧化成铁离子,二氧化锰被还原为锰离子,根据得失电子守恒和原子守恒,该反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(2). ①. 中和剂是调节溶液pH除去杂质离子,且不引入新的杂质,A. 加入Al2O3会和酸反应,引入铝离子杂质,故A错误;B.加入MgO和酸反应,能调节溶液pH且不引入新的杂质,故B正确;C.加入H2SO4后不能使溶液pH升高而除去Fe3+和Al3+,且引入新的杂质,故C错误;D. MnO2不能和稀酸反应,故D错误;答案为:B;
②. 根据Ksp[Al(OH)3]=1.0×10-33、Ksp[Fe(OH)3]=2.6×10-39可知,当铝离子全部沉淀时,铁离子已全部沉淀,结合氢氧化铝的溶度积常数可知,Ksp[Al(OH)3]=1.0×10-33=c(Al3+)×c3(OH-)= 1×10-6mol/L×c3(OH-),解得c(OH-)= 1×10-9mol/L,则c(H+)= 1×10-5mol/L,pH=5,故答案为:5;
(3). “置换”中发生的反应是锰置换出单质镍,离子方程式为Mn+Ni2+=Mn2++Ni,故答案为:Mn+Ni2+=Mn2++Ni;
(4). 据图可知,结晶与过滤过程中,体系温度均应维持在70℃,此时硫酸镁溶解度最大,硫酸锰溶解度小,便于析出硫酸锰晶体,故答案为:70;
(5).①. MnO2与Na2C2O4在酸性条件下反应生成锰离子、二氧化碳和水,根据得失电子守恒和原子守恒,该反应的离子方程式为:MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O,故答案为:MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O;
②. C2O42-在酸性条件下与MnO4-反应的离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,则剩余Na2C2O4的物质的量为:![]() c2mol/L×V2 ×10-3L=
c2mol/L×V2 ×10-3L=![]() c2V2 ×10-3mol,与MnO2反应的Na2C2O4的物质的量为:c1V1 ×10-3mol-
c2V2 ×10-3mol,与MnO2反应的Na2C2O4的物质的量为:c1V1 ×10-3mol-![]() c2V2 ×10-3mol,由MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O可知,MnO2的物质的量为:(c1V1 ×10-3-
c2V2 ×10-3mol,由MnO2+4H++C2O42-=Mn2++2CO2↑+2H2O可知,MnO2的物质的量为:(c1V1 ×10-3-![]() c2V2 ×10-3)mol,质量为:(c1V1 ×10-3-
c2V2 ×10-3)mol,质量为:(c1V1 ×10-3-![]() c2V2 ×10-3) mol×87g/mol=(c1V1 ×10-3-
c2V2 ×10-3) mol×87g/mol=(c1V1 ×10-3-![]() c
c![]() ,故答案为:
,故答案为:![]() 。
。