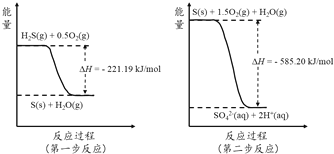
题目内容
【题目】25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是( )
A.C(s)+![]() O2(g)===CO(g) ΔH=-393.5 kJ/mol
O2(g)===CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1400 kJ/mol
【答案】D
【解析】
试题分析:燃烧热:1mol可燃物完全燃烧生成稳定氧化物时放出的热量,A、C完全燃烧生成稳定的氧化物为CO2,故错误;B、此反应是放热反应,△H<0,故错误;C、稳定氧化物时H2O的状态为液体,故错误;D、符合热化学反应方程式的书写,故正确。

练习册系列答案
相关题目