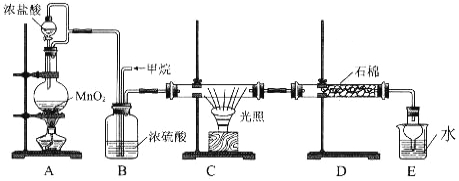
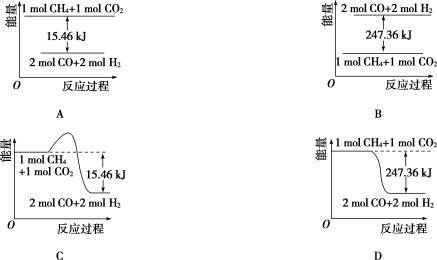
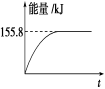
题目内容
【题目】下列说法或表达正确的是
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100mL0.1mol/L的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:IO3-+5I-+3H2O=3I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
A.全部
B.②⑤
C.②③④
D.②④
【答案】B
【解析】
试题分析:①HClO有强氧化性而具有漂白性,SO2和有色物质发生化合反应而漂白,活性炭具有吸附性,则漂白原理不同,①错误;②亚铁离子的还原性强于溴离子,氯气首先氧化亚铁离子,向100mL0.1mol/L的溴化亚铁即含有0.01mol溴化亚铁的溶液中通入0.05mol的氯气时氯气过量,因此发生反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,②正确;③非金属性Cl>S,可比较最高价含氧酸的酸性,不能比较HClO、稀H2SO4的氧化性,二者没有因果关系,③错误;④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式为IO3-+5I-+6H+=3I2+3H2O,④错误;⑤碳酸氢根离子电离产生氢离子,电离方程式:HCO3-+H2O![]() H3O++CO32-,⑤正确;⑥从上到下,卤族元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,其水溶液中氢卤酸的酸性依次增强,⑥错误;答案选B。
H3O++CO32-,⑤正确;⑥从上到下,卤族元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,其水溶液中氢卤酸的酸性依次增强,⑥错误;答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目