题目内容
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
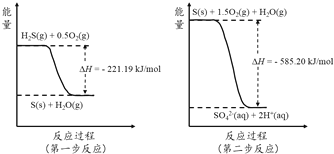
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为
(3)SO2时工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= 。
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”。)
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化入右图所示:
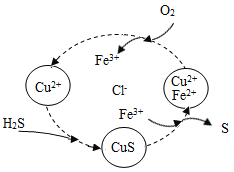
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较安全;相反,如果一个反应的平衡常数夏普与10-5,则认为这个反应很难进行。
已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:Ka1=1.3×10-7,Ka2=7.1×10-15,
通过计算说明反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)进行的程度
【答案】
(1)酸雨;SO2+H2O![]() HSO3-+H+;
HSO3-+H+;
(2)H2S(g)+2O2(g)=SO42-(aq)+2H+(aq) ΔH=-806.39KJ/mol ;
(3)①6.25×10-3mol/(L·min);②225(mol/L)-1;③减小;
(4)通入足量的空气(或氧气);K=Ksp(CuS)/Ka1·Ka2=6.83×10-15<10-5,反应很难进行;
【解析】
试题分析:(1)SO2的大量排放会导致酸雨,潮湿条件下,写出大气中SO2转化为HSO3-的方程式为SO2+H2O![]() HSO3-+H+,故答案为:酸雨;SO2+H2O
HSO3-+H+,故答案为:酸雨;SO2+H2O![]() HSO3-+H+;
HSO3-+H+;
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJmol-1;第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJmol-1;依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJmol-1;故答案为:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJmol-1;
(3)①反应在0-4min内的平均速率为v(SO2)=![]() =
= =6.25×10-3mol/(L·min),故答案为:6.25×10-3mol/(L·min);
=6.25×10-3mol/(L·min),故答案为:6.25×10-3mol/(L·min);
②此温度下,5min时反应的二氧化硫的物质的量为0.06mol,则反应的氧气的物质的量为0.03mol,剩余氧气0.02mol,则5min是反应已经达到平衡状态,平衡时c(SO2)=0.02mol/L,c(O2)= 0.01mol/L,c(SO3) = 0.03mol/L,反应的化学平衡常数K=![]() =225,故答案为:225;
=225,故答案为:225;
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),相当于增大压强,平衡正向移动,重新达到平衡时混合气体中SO2的百分含量将减小,故答案为:减小;
(4)①使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:通入足量的空气(或氧气或增大混合气体中空气的比例),故答案为:通入足量的空气(或氧气或增大混合气体中空气的比例);
②Ksp=c(Cu2+)c(S2-);H2S:Ka1=![]() ;Ka2=
;Ka2=![]() ,CS(s)+2H+Cu2++H2S,反应的K=
,CS(s)+2H+Cu2++H2S,反应的K=![]() =Ksp÷Ka2÷Ka1=8.4×10-36mol2L-2÷1.2×10-7molL-1÷7×10-15molL-1=1×10-14<10-5,所以反应难以进行;故答案为:此反应K﹦1×10-14<10-5,所以反应难以进行。
=Ksp÷Ka2÷Ka1=8.4×10-36mol2L-2÷1.2×10-7molL-1÷7×10-15molL-1=1×10-14<10-5,所以反应难以进行;故答案为:此反应K﹦1×10-14<10-5,所以反应难以进行。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案