题目内容
【题目】甲、乙两池电极材料都是铁棒与碳棒(如图),乙池箭头方向为电子移动方向。请回答:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的_________棒;乙池中的________棒。
②在乙池中阳极的电极反应是__________。
(2)若两池中均盛放滴加少量酚酞的饱和NaCl溶液。
①甲池中的铁容易发生腐蚀,该腐蚀属于电化学腐蚀中的_________腐蚀。
②测得乙池中有0.2mol电子发生转移,则标准状况下理论共有_________L气体生成。
【答案】C(碳) Fe(铁) 4OH--4e-=2H2O+O2↑ 吸氧 4.48L
【解析】
(1)若电解质溶液为硫酸铜溶液,甲池属于原电池,铁易失电子作负极,碳作正极,正极上铜离子得电子发生还原反应;乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极,阴极上铜离子得电子发生还原反应,阳极上氢氧根离子失电子;
(2)若电解质溶液为滴加少量酚酞的饱和NaCl溶液,
①甲装置是原电池,铁易失电子作负极,其电极反应式为Fe-2e-=Fe2+,电解质溶液为中性,据此分析解答;
②若电解质溶液为氯化钠溶液,则乙中为电解氯化钠溶液,阳极氯离子失电子生成氯气,阴极氢离子得电子生成氢气,根据电解池总反应计算解答。
(1)①若电解质溶液为硫酸铜溶液,甲装置是原电池,铁易失电子作负极,碳作正极,正极上铜离子得电子发生还原反应,生成红色的铜,乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极,阴极上铜离子得电子发生还原反应生成红色的铜;
②根据①分析可知,在乙池中铁电极为阴极,阴极上铜离子得电子发生还原反应生成红色的铜,其电极反应式为:Cu2++2e-=Cu;C电极为阳极,根据放电顺序,阳极上OH-放电,阳极的电极反应为:4OH--4e-=2H2O+O2↑;
(2)若电解质溶液为滴加少量酚酞的饱和NaCl溶液,
①甲装置是原电池,铁易失电子作负极,其电极反应式为Fe-2e-=Fe2+,电解质溶液为中性,C为正极,其电极反应为:2H2O+O2+4eˉ=4OH-,该腐蚀属于电化学腐蚀中的吸氧腐蚀;
②乙池属于电解池,根据电子流向知,C电极为阳极,Fe电极为阴极,乙中为电解氯化钠溶液,阳极氯离子失电子生成氯气,阴极氢离子得电子生成氢气,电解池总反应2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,根据反应可知,转移2mol电子生成1mol氢气和1mol氯气,则当有0.2mol电子发生转移时,生成0.1mol氢气和0.1mol氯气,标况下气体的体积为(0.1mol+0.1mol)×22.4L/mol=4.48L。
2OH-+H2↑+Cl2↑,根据反应可知,转移2mol电子生成1mol氢气和1mol氯气,则当有0.2mol电子发生转移时,生成0.1mol氢气和0.1mol氯气,标况下气体的体积为(0.1mol+0.1mol)×22.4L/mol=4.48L。

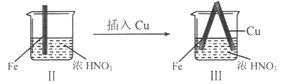
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化