题目内容
17.有关下列实验操作和相应的离子方程式的说法正确的是( )| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| C. | 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
分析 A.镁离子、氢离子与氢氧根离子发生反应,氢离子优先反应;
B.氢氧化钠过量反应生成碳酸钙、碳酸钠和水;
C.溴离子与二价铁离子具有还原性,二价铁离子还原性强于溴离子,氯气先氧化二价铁,再氧化溴离子;
D.浓盐酸可以被酸性高锰酸钾溶液氧化.
解答 解:A.等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++4OH-+2H+=Mg(OH)2↓+2H2O,故A错误;
B.Ca(HCO3)2与过量的NaOH溶液的反应的离子反应为Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故B错误;
C.等物质的量的FeBr2和Cl2反应,亚铁离子优先反应,溴离子部分反应,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故C正确;
D.盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故D错误;
故选:C.
点评 本题考查了离子方程式的正误判断,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:原子个数是否守恒、电荷数是否守恒、化学式拆分是否正确、是否符合反应客观事实等,题目难度不大.

练习册系列答案
相关题目
7.下表所列的是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)B元素位于周期表中第三周期ⅢA族.
(2)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(3)B、E形成的化合物为Al2O3(填化学式).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
(2)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(3)B、E形成的化合物为Al2O3(填化学式).
8.下列化学反应中反应物总能量高于生成物物总能量的是( )
| A. | CO2与炭化合 | B. | 碳酸钙分解反应 | C. | 铝热反应 | D. | 制水煤气反应 |
2.下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是( )
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失 | |
| C. | 锥形瓶用蒸馏水洗,未用待测液润洗 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
9.下列说法正确的是( )
| A. | 乙烯和乙烷都能在空气中燃烧而被氧气氧化,具有强还原性,所以它们也能被强氧化剂高锰酸钾氧化 | |
| B. | 苯和乙烯都易发生加成反应,乙烷能发生取代反应 | |
| C. | 将苯与浓硝酸混合共热可制得硝基苯,属加成反应 | |
| D. | 苯分子为平面正六边形结构,6个碳原子之间的键完全相同 |
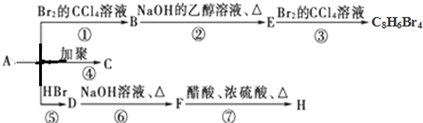
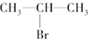 (主要产物)
(主要产物)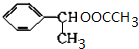 ,
,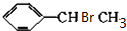 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$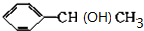 +NaBr.
+NaBr.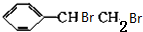 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$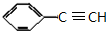 +2NaBr+2H2O
+2NaBr+2H2O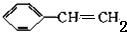 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$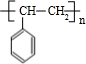 .
.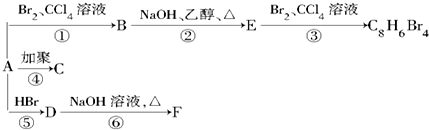
 ,D
,D ,E
,E ,
, +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ 如图是某兴趣小组探究不同条件下化学能转变为电能的装置
如图是某兴趣小组探究不同条件下化学能转变为电能的装置