题目内容
12.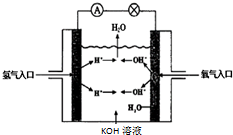 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:正极反应式为O2+4e-+2H2O=2H2O,溶液PH减小(填“增大”、“不变”或“减小”).
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2=2LiHⅡ.LiH+H2O=LiOH+H2↑
反应Ⅰ中,7gLi可吸收标况下H211.2L,此时转移电子1moL.
分析 ①在原电池中,负极上失电子,燃料发生氧化反应,正极上得电子,氧气发生还原反应,根据电极反应确定溶液pH的变化;
②氧化还原反应中,还原剂被氧化,所含元素化合价升高,结合反应的化学方程式计算.
解答 解:①氢氧燃料电池该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为H2+2OH--2e-═2H2O,正极上氧气得电子,发生还原反应,反应式为:O2+4e-+2H2O=2H2O,该电池反应的产物是水,所以氢氧化钾的浓度减小,pH减小,故答案为:O2+4e-+2H2O=2H2O;减小;
②反应Ⅰ中Li元素化合价升高,被氧化,Li为还原剂,n(Li)=$\frac{7g}{7g/mol}$=1mol,由方程式可知7g Li可吸收标况下H20.5mol,标准状况下的体积为11.2L,转移电子1mol,
故答案为:11.2;1.
点评 本题考查了原电池原理,为高频考点,涉及电极反应式的书写计算等问题,根据得失电子确定正负极,再结合正负极上发生的反应来分析解答,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是( )
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失 | |
| C. | 锥形瓶用蒸馏水洗,未用待测液润洗 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
3.下列各组化合物中,化学键类型都相同的是( )
| A. | CaCl2和Na2O2 | B. | Na2O和Na2O2 | C. | CO2和CS2 | D. | HCl和NaOH |
20.100mL 2mol/L的盐酸跟过量的锌片反应,一定温度下为减慢反应速率而又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入适量NaNO3溶液 | B. | 加入适量NaOH溶液 | ||
| C. | 加入适量Na2CO3溶液 | D. | 加入适量NaCl溶液 |
17.下列物质中,一氯代物的同分异构体有2种的是( )
| A. | 乙烷 | B. | 丙烷 | C. | 正戊烷 | D. | 新戊烷 |
16.下列各组中两种微粒所含电子数不相等的是( )
| A. | F-和OH- | B. | Na+和Al3+ | C. | K+和Cl- | D. | Mg2+和S2- |