题目内容
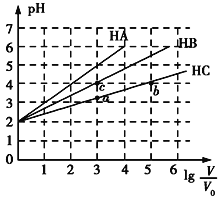
【题目】常温下,H2SO3的电离常数:Ka1=1.54×102,Ka2=1×107。向mmL0.1mol/LH2SO3溶液中滴加0.1mol·L1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法不正确的是
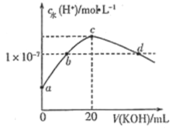
A.m=10
B.c点对应的溶液中存在c(K+)>c(HSO3-)+2c(SO32)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH的K=1×107
【答案】C
【解析】
A. 根据水的电解程度最大为c点,则说明H2SO3与KOH恰好完全反应生成K2SO3,则2n(H2SO3) = n(KOH),2×0.1mol/L×mmL=0.1mol·L1 ×20mL,解得m=10,故A正确;
B. c点对应的溶液中溶质为K2SO3,根据电荷守恒得到c(K+)+ c(H+) = c(OH-) + c(HSO3-)+2c(SO32),溶液呈碱性即 c(OH-)>c(H+),因此有c(K+) >c(HSO3-)+2c(SO32),故B正确;
C. a点呈酸性,c点呈碱性,从酸性到碱性,因此b呈中性,pH=7,d是在c点呈碱性基础上再加KOH,则d点依然是碱性,即d点溶液的pH>7,故C错误;
D. SO32-+H2OHSO3-+OH的![]() ,故D正确;
,故D正确;
综上所述,答案为C。

【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____