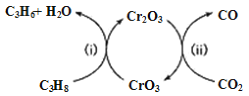
题目内容
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
CH2=CH2+Br2 → BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚
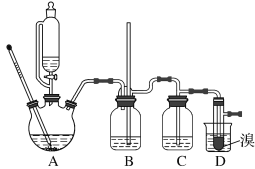
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132. | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________(填正确选项前的字母)。
a .引发反应 b. 加快反应速度 c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体。
a .水 b .浓硫酸 c .氢氧化钠溶液 d .饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_______________________。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”或“下”)。
(5)若产物中有少量未反应的Br2,最好用________(填正确选项前的字母)洗涤除去。
a 水 b 氢氧化钠溶液 c 碘化钠溶液 d 乙醇
(6)若产物中有少量副产物乙醚,可用________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是_______________________;但又不能过度冷却(如用冰水),其原因是_______________________________。
【答案】d c 溴的颜色完全褪去 下 b 蒸馏 避免溴大量挥发 1,2-二溴乙烷的熔点低,过度冷却会凝固而堵塞导管
【解析】
实验室制备1,2-二溴乙烷:三颈烧瓶A中发生的反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O,如果D中导气管发生堵塞,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管可判断装置是否堵塞,装置B起缓冲作用,浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓)
CH2=CH2↑+H2O,如果D中导气管发生堵塞,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管可判断装置是否堵塞,装置B起缓冲作用,浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓) ![]() 4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,装置C中放氢氧化钠溶液,发生反应SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,除去杂质气体,乙烯含有不饱和键碳碳双键,能与卤素单质发生加成反应,D中乙烯和溴加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,制得1,2-二溴乙烷。
4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,装置C中放氢氧化钠溶液,发生反应SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,除去杂质气体,乙烯含有不饱和键碳碳双键,能与卤素单质发生加成反应,D中乙烯和溴加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,制得1,2-二溴乙烷。
(1)乙醇在浓硫酸、140℃的条件下,发生分子间脱水生成乙醚,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是:减少副产物乙醚生成,
因此,本题正确答案是:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,NaOH溶液不吸收乙烯,则装置C中试剂为NaOH溶液,故选c,
因此,本题正确答案是:c;
(3)溴水为橙色,乙烯和溴水发生的加成反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,生成的1,2-二溴乙烷为无色,溴的颜色完全褪去,表明该制备反应已经结束,
因此,本题正确答案是:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,
因此,本题正确答案是:下;
(5)a.溴更易溶于1,2-二溴乙烷,用水无法除去溴,故a不选;
b.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,但1,2-二溴乙烷在氢氧化钠水溶液、加热条件下容易发生水解反应,低温下,可用氢氧化钠除去溴杂质,故b选;
c.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c不选;
d.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故d不选。
因此,本题正确答案是:b;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
因此,本题正确答案是:蒸馏;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会凝固而堵塞导管,
因此,本题正确答案是:避免溴大量挥发;1,2-二溴乙烷的熔点低,过度冷却会凝固而堵塞导管。

 名校课堂系列答案
名校课堂系列答案【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
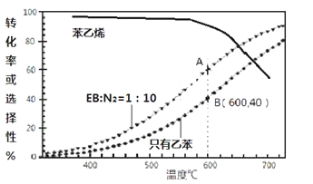
①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。