题目内容
周期表中,前20号元素内X、Y元素的离子符号是xm+、yn-,他们的核外电子排布相同,据此可推得:
(1)元素X和 Y所属周期的周期数之差为
(2)元素X和Y的核电荷数之差为(用含m、n的代数式表示)
(3)Xm+、yn-的离子半径由大到小的顺序是
(1)1(2分)
(2)m+n (2分)
(3)Yn-、Xm+(用>表示也可给分) (2分)
解析试题分析:(1)X元素的原子失去最外层电子,电子层减少1层,Y得到电子,电子层数不变,当他们的离子电子层结构相同时元素X和 Y所属周期的周期数之差为1;(2)两种离子所带电子数相等,有X-m=Y+n,X-Y=m+n;(3)电子层相同,质子数多半径小,Yn->Xm+。
考点:考查原子结构与元素周期律等有关问题。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
若某原子的外围电子排布式为4d15s2,则下列说法正确的是
| A.该元素在元素周期表中的位置为第五周期IIIB |
| B.该元素位于s区 |
| C.该元素原子为非金属 |
| D.该元素原子N能层共有8个电子 |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
| A.原子半径的大小顺序: r(Y)>r(Z)>r(W) |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是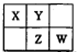
| A.元素X和元素W最高正价代数和一定为8 |
| B.若元素X的原子序数为a,则Z的原子序数一定为a+9 |
| C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 |
| D.原子半径的大小顺序为:rW>rZ>rX>rY |
短周期元素X、Y、Z在周期表中所处的位置如图所示,三种元素的原子质子数之和为32,下列说法正确的是
| X | | Z |
| | Y | |
A.三种元素中,Z元素的最高价氧化物对应的水化物的酸性最强
B.X、Z两种元素的气态氢化物相互反应的产物是共价化合物
C.三种元素对应的气态氢化物中,Z元素形成的氢化物最稳定
D.Y元素的气态氢化物与Y的最高价氧化物对应的水化物不可能发生反应