题目内容
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
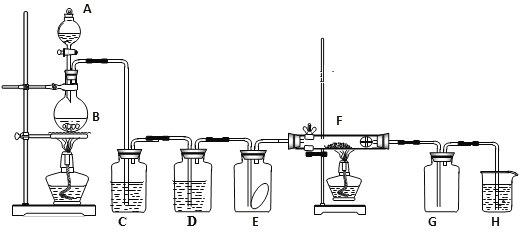
(1)装置C中盛装的溶液是____________,D中试剂的作用是________。
(2)E中的红色布条是否褪色?____(填“是”或“否”);写出F中反应的化学反应方程式:________________,其反应现象为_____________。
(3)新制氯水呈黄绿色说明其中含有_____,(填化学式,下同),若将紫色石蕊溶液滴入新制氯水中,可观察到的现象是_________________,说明其中含有__________。
(4)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,该反应的化学方程式为_________________________。
【答案】饱和食盐水 干燥氯气 否 Cu+Cl2![]() CuCl2 产生大量棕黄色烟 Cl2 溶液先变红后褪色 HCl、HClO 氢氧化钠溶液 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
CuCl2 产生大量棕黄色烟 Cl2 溶液先变红后褪色 HCl、HClO 氢氧化钠溶液 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
分液漏斗A中的浓盐酸滴入烧瓶B中的二氧化锰固体中加热发生反应生成氯气,氯气中含水蒸气和氯化氢气体杂质,通过装置C中饱和食盐水除去氯化氢气体,通过装置D中浓硫酸除去水蒸气,装置E检验干燥的氯气是否具有漂白性,装置F中的铜网加热发生反应生成棕黄色的烟得到氯化铜,装置G收集氯气,剩余氯气通过装置H中的氢氧化钠溶液吸收;
(1)用饱和食盐水除去氯气中的氯化氢;装置D中为浓硫酸除去氯气中的水蒸气;
(2)E瓶中放有干燥红色布条,通入干燥氯气后不会褪色;F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕黄色烟;
(3)新制氯水中存在Cl2+H2OHCl+HClO,所以新制氯水中存在Cl2、HClO、H2O、H+、Cl-、ClO-、OH-,其中HClO具有漂白性和强氧化性,结合对应物质的性质解答;
(4)氯气有毒需要用氢氧化钠溶液吸收,氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水,常用于工业上制漂白精。
(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,生成的氯气中混有氯化氢气体,用饱和食盐水除去,装置D中为浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;
MnCl2+Cl2↑+2H2O,生成的氯气中混有氯化氢气体,用饱和食盐水除去,装置D中为浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;
(2)E中干燥的氯气遇到干燥有色布条不褪色,说明氯气无漂白作用,F装置是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕黄色烟,反应的化学方程式为:Cu+Cl2![]() CuCl2;
CuCl2;
(3)新制氯水中存在Cl2+H2OHCl+HClO,新制氯水中存在Cl2、HClO、H2O、H+、Cl、ClO、OH,因含有氯气,则溶液呈淡黄绿色;向氯水中紫色石蕊溶液,石蕊溶液遇到HCl变红,同时生成的HClO有漂白性,所以溶液又褪色,即将紫色石蕊溶液滴入氯水中可观察到:溶液先变红后褪色;
(4)氯气有毒,需要用氢氧化钠溶液吸收,所以H中试剂为氢氧化钠溶液,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水,碳酸反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

【题目】(1)某元素的全部电离能(单位:eV)如下:
I1 | I2 | I3 | I4 | I5 | I6 | I7 | I8 |
13.6 | 35.1 | 54.9 | 77.4 | 113.9 | 138.1 | 739.1 | 871.1 |
写出该元素价电子轨道表示式_______________。
(2)分子中的大π 键可用符号![]() 表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为
表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为![]() 。
。
①试判断 SO2 最外层一共有_______________对孤对电子。
②HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-的键角为_______________,N![]() 中的大π 键应表示为_______________。
中的大π 键应表示为_______________。
(3)根据对角线规则,Be、Al 的化学性质相似,写出 Be(OH)2 与 NaOH 反应的离子方程式是________________________________。