��Ŀ����
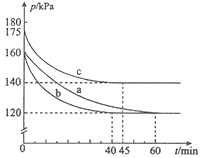
����Ŀ��ij��ɫ��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42-�������еļ��֣��������Һ�м���ijŨ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ��ʾ������˵��һ����ȷ����( )

A.һ������H+��Mg2+��Al3+��NH4+��һ��������Na+��SO42-��Fe3+
B.һ������H+��Al3+��NH4+��SO42-�����ܴ���Na+��Mg2+
C.��Һ��c(H+)��c(Al3+)��c(Mg2+)=1��1��2
D.��Һ��![]()
![]()
![]()
���𰸡�D
��������
��ɫ��Һ�����ػ�ɫ����Fe3+����ͼ��֪��ʼ����NaOHû�г����������������һ����H+�������г���������������һ����Al3+����û����ʧ����һ����Mg2+���м�γ������������䣬ӦΪNH4++OH-=NH3��H2O�ķ�Ӧ������NH4+���������ӷ�Ӧ���������������жϼ�����ػ�ѧ����ʽ���м��㣻Ϊ�˱��ֵ���غ㻹Ҫ����������SO42������ȷ���Ƿ����Na+��
��ͼ���֪����ʼʱ����������˵������H+��H++OH-=H2O������������NaOH��Һ�����Ϊ1���������H+1mol��ͼ������һ��ƽ̨��˵������OH-ʱ�������ɣ���NH4+��NH4++OH-=NH3��H2O��笠�������������Ϊ3���������NH4+3mol�������ܽ�ķ�ӦΪAl(OH)3+OH��= AlO2-+2H2O��������������Ϊ1�������֪����Al3+1mol������Al3++3OH��=Al(OH)3��������������NaOH��Һ�����Ϊ3��������Ի���2�������������Ӧ������þ���ӵij�������Mg2++2OH-=Mg(OH)2�����ú���Mg2+��1mol�������Һ���Դ��ڳ���ΪMg(OH)2��Ϊ�˱��ֵ���غ�϶�����������SO42������ȷ���Ƿ����Na+����
A.һ������SO42������ȷ���Ƿ����Na+��A����
B.û����������������Һ�ij�����������þ��˵��һ������Mg2+��B����
C.��ͼ�ж���Һ��c��H+����c��Al3+����c��Mg2+��Ϊ1��1��1��C����
D. H+��NH4+��Mg2+��Al3+�����������9 mol������Ϊ�˱��ֵ���غ㣬����Na+����SO42��Ϊ4.5 mol��![]() ��ֵ����
��ֵ����![]() ������Na+����SO42������4.5 mol����Һ��
������Na+����SO42������4.5 mol����Һ��![]() ��ֵС��
��ֵС��![]() ��D��ȷ��
��D��ȷ��
��ѡD��

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�