题目内容
【题目】最新研究表明,有毒气体H2S具有参与调节神经信号传递、舒张血管减轻高血压的功能。
(1)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是______(填标号)。
A.H2S 的还原性强于H2SO3
B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1
C.H2S 不能与NaHCO3溶液反应,而H2SO3可以
D.等浓度的两种溶液pH 值: NaHS > NaHSO3
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知(1)式和(5)式的热化学方程式分别为___________、________________,制得等量H2所需能量系统I是系统II的_______倍。
(3)H2S与CO2在高温下发生反应: H2S(g)+CO2(g) ![]() COS(g) +H2O(g) △H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
COS(g) +H2O(g) △H >0;保持T1温度,将0.20mol CO2与0.80mol H2S充入2.5L的空钢瓶中,反应平衡后COS的物质的量分数为0.02
①H2S的平衡转化率a1=_______%,反应平衡常数K=______________。
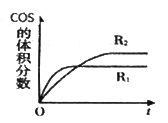
②在不同条件下发生上述反应,COS 的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是____________(填字母序号)CO2的转化率a2__a1,(填”>”或“<”)
A.压强 B.温度 C.催化剂
(4)反应开始,保持T1温度,2L 钢瓶中充入0.08molCO2、0.40mo1H2S、0.02molCOS和0.02molH2O,则此时V正___V逆(填”>”或“<”)判断依据是___________________________。
【答案】 BCD ![]() H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 14.3倍 2.5 2.8×10–3 B > > Qc>K,向正反应方向进行
H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 14.3倍 2.5 2.8×10–3 B > > Qc>K,向正反应方向进行
【解析】(1)A. 还原性与酸性强弱无关,故A错误;B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1,说明亚硫酸的电离程度大于氢硫酸,亚硫酸的酸性大于氢硫酸,故B正确;C.H2S 不能与NaHCO3溶液反应,而H2SO3可以说明亚硫酸的酸性大于碳酸大于氢硫酸,故C正确;D.越弱越水解,等浓度的两种溶液pH值: NaHS > NaHSO3,说明酸性亚硫酸大于氢硫酸,故D正确;故选BCD;
(2)系统(Ⅰ)涉及水的分解,系统(Ⅱ)涉及硫化氢的分解,利用盖斯定律分别将系统(Ⅰ)的(2)、(3)和H2O(l)=H2(g)+ ![]() O2(g) △H=+286kJ/mol处理得H2SO4(aq)=SO2(g)+ H2O(l)+
O2(g) △H=+286kJ/mol处理得H2SO4(aq)=SO2(g)+ H2O(l)+ ![]() O2(g) △H=+327kJ/mol;系统(Ⅱ)的(2)、(3)、(4)处理得H2S (g)=H2(g)+S(s) △H=+20kJ/mol;
O2(g) △H=+327kJ/mol;系统(Ⅱ)的(2)、(3)、(4)处理得H2S (g)=H2(g)+S(s) △H=+20kJ/mol;
根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II,制得等量H2所需能量系统I是系统II的![]() =14.3倍,故答案为:H2SO4(aq)=SO2(g)+ H2O(l)+
=14.3倍,故答案为:H2SO4(aq)=SO2(g)+ H2O(l)+ ![]() O2(g) △H=+327kJ/mol;H2S (g)+=H2(g)+S(s)△H=+20kJ/mol;14.3倍;
O2(g) △H=+327kJ/mol;H2S (g)+=H2(g)+S(s)△H=+20kJ/mol;14.3倍;
(3)对于反应H2S(g)+CO2(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
起始(mol) 0.800.20 0 0
转化(mol) x x x x
平衡(mol) 0.80-x0.20-x x x
反应平衡后COS的物质的量分数为0.02,则![]() =0.02,x=0.02。
=0.02,x=0.02。
①H2S的平衡转化率a1=![]() ×100%=2.5%,体积为2.5L,则平衡时各物质的浓度为c(H2S)=
×100%=2.5%,体积为2.5L,则平衡时各物质的浓度为c(H2S)= ![]() mol/L=0.312mol/L,c(CO2)
mol/L=0.312mol/L,c(CO2) ![]() mol/L=0.072mol/L,c(COS)=c(H2O)=
mol/L=0.072mol/L,c(COS)=c(H2O)= ![]() mol/L=0.008mol/L,则K=
mol/L=0.008mol/L,则K=![]() =0.00285≈2.8×10–3,故答案为:2.5;2.8×10–3;
=0.00285≈2.8×10–3,故答案为:2.5;2.8×10–3;
②A.该反应前后气体的物质的量不变,改变压强,平衡不移动,错误;B.改变温度,平衡移动发生移动,正确;C.改变催化剂,平衡不移动,错误;故选B;升高温度,化学平衡向吸热反应方向移动,因此平衡向正反应方向移动,H2S的转化率增大,即a2>a1,故答案为:B;>;
(4)反应开始,保持T1温度,2L钢瓶中充入0.08molCO2、0.40mo1H2S、0.02molCOS和0.02molH2O,此时Qc=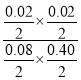 =
=![]() =0.0125>K=0.00285,反应向正反应方向进行,V正>V逆,故答案为:>;Qc >K,向正反应方向进行。
=0.0125>K=0.00285,反应向正反应方向进行,V正>V逆,故答案为:>;Qc >K,向正反应方向进行。

【题目】硼是动植物所必须的微量元素,其单质和化合物广泛应用于冶金、机械、化工、核工业、医药、农业等部门。利用硼镁矿(主要成分为Mg2B2O3·5H2O)制取制硼酸、金属镁及粗硼的工艺流程图如下:
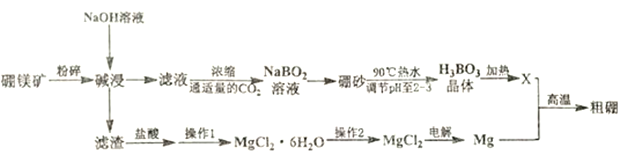
已知:①硼砂为Na2B4O7·10H2O
②硼酸(H3BO3)是一种可溶于水的一元弱酸,与过量的NaOH反应生成Na[B(OH)4]
③硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
(1)粉碎硼铁矿的目的是:______________;Mg2B2O5·H2O中B的化合价为:______价。
(2)滤渣的主要成分是: ________
(3)硼酸的电子式: ________;写出硼酸在水中电离的方程式: ________________;
(4)X为硼酸晶体加热完全脱水后的产物,其与Mg反应制取粗硼的化学方程式为: ________;
(5)硼砂溶于90℃热水后,常用稀硫酸调pH至2~3(酸性)制取HBO3晶体,该反应的离子方程式为: ________________;从上述溶液中获得H3BO3晶体的操作: ________________。