题目内容
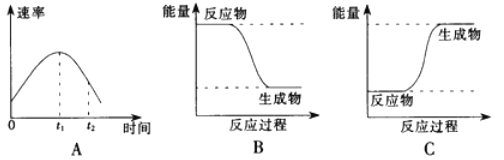
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是_________________________。(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。
(2)已知拆开1mo1H-H键、1molN![]() N、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。当1mo1 NH3_______________(填“放出”或“吸收”)________kJ 的热量。
N、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。当1mo1 NH3_______________(填“放出”或“吸收”)________kJ 的热量。
【答案】 放热 B 吸收 46
【解析】(1)在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,开始时盐酸的浓度减小,速率应减小,但实际上增大,说明温度对速率的影响大于浓度对速率的影响,则该反应放热;放热反应中,反应物的总能量大于生成物的总能量,则图像B正确,故答案为:放热;B;
(2)在反应2NH3N2+3H2中,断裂2mol NH3,共断裂6mol N-H键,吸收的能量为:6×391kJ=2346kJ,生成3mol H-H键,1mol N≡N键共放出的能量为:3×436kJ+946kJ=2254kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2346kJ-2254kJ=92kJ,所以当1molNH3分解吸收热量为46kJ,故答案为:吸收;46。

【题目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列问题:
(1)J元素的元素的名称:___________。
(2)G元素与I 元素形成的化合物的电子式是___________,
A、G、E形成的化合物中含有的化学键类型为_____________________________。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,
属于两性氢氧化物的是_______________(用化合物的化学式表示)。
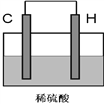
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________极(填正或负),并写出该电极反应式为:____________________。