题目内容
【题目】硼是动植物所必须的微量元素,其单质和化合物广泛应用于冶金、机械、化工、核工业、医药、农业等部门。利用硼镁矿(主要成分为Mg2B2O3·5H2O)制取制硼酸、金属镁及粗硼的工艺流程图如下:
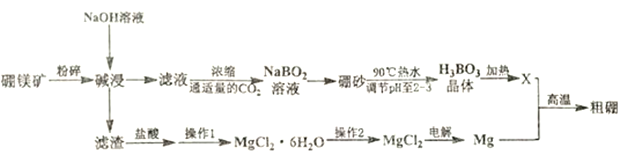
已知:①硼砂为Na2B4O7·10H2O
②硼酸(H3BO3)是一种可溶于水的一元弱酸,与过量的NaOH反应生成Na[B(OH)4]
③硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
(1)粉碎硼铁矿的目的是:______________;Mg2B2O5·H2O中B的化合价为:______价。
(2)滤渣的主要成分是: ________
(3)硼酸的电子式: ________;写出硼酸在水中电离的方程式: ________________;
(4)X为硼酸晶体加热完全脱水后的产物,其与Mg反应制取粗硼的化学方程式为: ________;
(5)硼砂溶于90℃热水后,常用稀硫酸调pH至2~3(酸性)制取HBO3晶体,该反应的离子方程式为: ________________;从上述溶液中获得H3BO3晶体的操作: ________________。
【答案】 增大接触面积,加快反应速率,使反应充分进行,提高原料利用率(答到其中两点即可得分) +3 Mg(OH)2 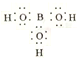 H3BO3 + H2O
H3BO3 + H2O![]() [B(OH)4]-+ H+ 3Mg+B2O3
[B(OH)4]-+ H+ 3Mg+B2O3![]() 2B+3MgO B4O72-+2H++5H2O=4H3BO3 蒸发浓缩、冷却结晶、过滤
2B+3MgO B4O72-+2H++5H2O=4H3BO3 蒸发浓缩、冷却结晶、过滤
【解析】(1)粉碎硼铁矿的目的是增大反应物接触面积,加快反应速率,使反应充分进行,提高原料利用率;Mg2B2O5·H2O中Mg是+2价,O是-2价,根据正负价代数和为0可知B的化合价为+3价。(2)滤渣能与盐酸反应生成氯化镁,因此主要成分是Mg(OH)2;(3)硼酸是共价化合物,电子式为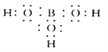 ;硼酸(H3BO3)是一种可溶于水的一元弱酸,与过量的NaOH反应生成Na[B(OH)4],则硼酸在水中电离的方程式为H3BO3+H2O
;硼酸(H3BO3)是一种可溶于水的一元弱酸,与过量的NaOH反应生成Na[B(OH)4],则硼酸在水中电离的方程式为H3BO3+H2O![]() [B(OH)4]-+H+;(4)X为硼酸晶体加热完全脱水后的产物,根据B的化合价可知X化学式为B2O3,与Mg反应制取粗硼的化学方程式为3Mg+B2O3
[B(OH)4]-+H+;(4)X为硼酸晶体加热完全脱水后的产物,根据B的化合价可知X化学式为B2O3,与Mg反应制取粗硼的化学方程式为3Mg+B2O3![]() 2B+3MgO;(5)硼砂溶于90℃热水后,常用稀硫酸调pH至2~3(酸性)制取HBO3晶体,该反应的离子方程式为B4O72-+2H++5H2O=4H3BO3;硼酸的溶解度随温度的升高而增大,则从上述溶液中获得H3BO3晶体的操作为蒸发浓缩、冷却结晶、过滤。
2B+3MgO;(5)硼砂溶于90℃热水后,常用稀硫酸调pH至2~3(酸性)制取HBO3晶体,该反应的离子方程式为B4O72-+2H++5H2O=4H3BO3;硼酸的溶解度随温度的升高而增大,则从上述溶液中获得H3BO3晶体的操作为蒸发浓缩、冷却结晶、过滤。