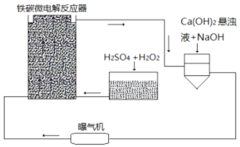
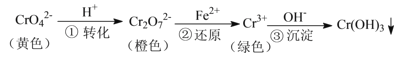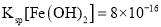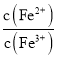题目内容
【题目】下列叙述正确的是( )
A.制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸
B.SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同
C.可用CuSO4溶液除去制乙炔时混有的杂质H2S
D.在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI)
【答案】C
【解析】
![]() 乙酸乙酯与氢氧化钠溶液在加热时发生水解反应,应使用饱和碳酸钠溶液,A错误;
乙酸乙酯与氢氧化钠溶液在加热时发生水解反应,应使用饱和碳酸钠溶液,A错误;
B. 二氧化硫与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,乙烯与溴水发生加成反应而使溴水褪色,二者反应的原理不同,B错误;
C. CuSO4可与H2S气体反应生成CuS黑色沉淀,因此可用于除去制取乙炔时混有的杂质H2S气体,C正确;
D. 在AgI饱和溶液中加入KCl固体若c(Ag+)·c(Cl-)>Ksp(AgCl),就可产生白色沉淀,不能说明Ksp(AgCl)<Ksp(AgI),D错误;
故合理选项是C。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |