题目内容
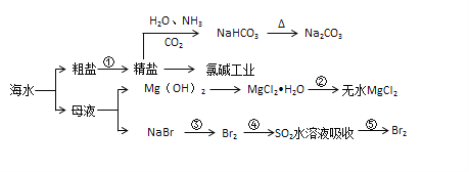
【题目】为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
乙:![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)蒸馏过程中温度应控制在80℃~90℃,温度过高或过低都不利于生产,原因是_______。
(2)甲同学步骤④所发生反应的离子方程式为_______。
(3)某同学在进行蒸馏操作时,采用如图所示装置:
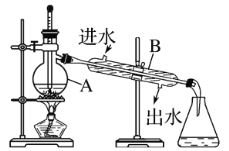
①仪器A的名称是_____
②写出图中两处明显的错误:________。
③实验时A中除加入混合溶液外,还需加入少量_____,其作用是___。
(4)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是____(填“甲”或“乙”),理由是________。
【答案】温度过低,未达到溴的沸点,溴变成蒸气少,温度过高,会有大量水蒸出 SO2+Br2+2H2O=4H++SO42-+2Br- 蒸馏烧瓶 温度计的水银球应放在蒸馏烧瓶支管口处,冷却水应下口进上口出 碎瓷片 防止暴沸 甲 含溴海水中溴的浓度低,直接蒸馏成本高,甲流程中③④⑤步实际上是溴的富集过程,可提高溴的浓度,减少能源消耗,降低成本
【解析】
(1)从溴水中蒸馏出溴蒸气,可根据溴单质、水的沸点的不同进行分析;
(2)步骤④反应为溴单质与SO2在水溶液中发生反应产生氢溴酸和硫酸;
(3)①根据仪器结构判断仪器A的名称;
②蒸馏烧瓶中温度计是测量蒸气的温度;冷凝水的水流方向应该是下进上出;
(4)从海水中含有的溴化物是浓度、能耗、成本等方面来对比方法甲、乙两种方法。
(1) 从溴水中分离出溴蒸气,采用蒸馏方法,温度过低,未达到溴的沸点,溴变成蒸气少,温度过高,会有大量水蒸出,所以蒸馏过程中温度应控制在80℃~90℃,温度过高或过低都不利于生产;
(2)步骤④反应为溴单质与SO2在水溶液中发生反应产生氢溴酸和硫酸,该反应的离子方程式为:SO2+Br2+2H2O=4H++SO42-+2Br-;
(3)①根据仪器结构判断仪器A的名称是蒸馏烧瓶;
②蒸馏方法分离溴水中溴蒸气,温度计是测量蒸气的温度,所以温度计水银球应该在蒸馏烧瓶的支管口附近;为了充分冷凝,采用逆流原理,冷凝水的水流方向应该是下口进上口出;
(4)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是甲,理由是含溴海水中溴的浓度低,直接蒸馏成本高,甲流程中③④⑤步实际上是溴的富集过程,可提高溴的浓度,减少能源消耗,降低成本,因此更符合实际生产的需要。

【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体二氧化碳的研究一直是科技界关注的重点。在催化剂存在下用H2还原CO2 是解决溫室效应的重要手段之一,相关反应如下:
已知H2 和CH4的燃烧热分别为285.5kJ/mol 和890.0kJ/mol。
H2O(1) =H2O(g) △H= +44 kJ/mol
试写出H2 还原CO2 生成CH4和H2O(g)的热化学方程式_____________。
(2)CO2在Cu-ZnO催化下,可同时发生如下的反应I、II,其可作为解决温室效应及能源短缺的重要手段。
I.CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) △H1=-57.8 kJ/mol
CH3OH(g) +H2O(g) △H1=-57.8 kJ/mol
II.CO2(g) +H2(g)![]() CO(g) + H2O(g) △H2 = +41.2 kJ/mol
CO(g) + H2O(g) △H2 = +41.2 kJ/mol
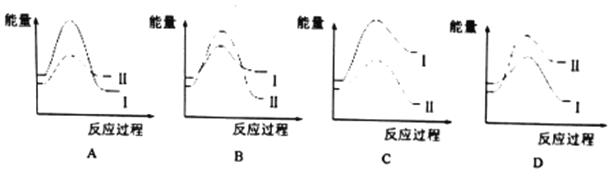
①某温度时,若反应I的速度v1大于反应II的速度以v2,则下列反应过程的能量变化正确的是_______(填选项)。
②对于气体参加的反应,,表示平衡常数Kp时,用气体组分(B)的平衡分压p(B)代替该气体物质的量浓度c(B)。
已知:气体各组分的分压p(B),等于总压乘以其体积分数。
在Cu-ZnO存在的条件下,保持温度T时,在容积不变的密闭容器中,充入一定量的CO2 及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,P0=1.2p,则表中n1=____;若此时
(3)汽车尾气是雾霾形成的原因之一。研究氮氧化物的处理方法可有效减少雾霾的形成,可采用氧化还原法脱硝:
4NO(g) +4NH3(g) +O2(g) ![]() 4N2(g) +6H2O(g) △H <0
4N2(g) +6H2O(g) △H <0
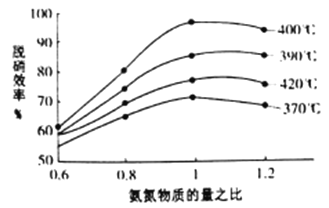
根据下图判断提高脱硝效率的最佳条件是________;氨氮比一定时,在400℃时,脱硝效率最大,其可能的原因是______________。
(4)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s) +2NO(g)![]() N2(g) +CO2(g) △H>0
N2(g) +CO2(g) △H>0
在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______。
A.通入一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通入一定量的NO E.加入一定量的活性炭 F.适当升高温度