题目内容
【题目】Ⅰ.将等质量的锌片和铜片用导线相连插入500 mL CuSO4溶液中构成如图所示的装置。
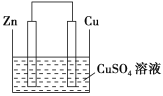
(1)该装置为____装置,该装置中发生反应的总离子方程式为____,铜片周围溶液会出现________的现象。
(2)若2 min后测得锌片的质量减少1.3 g,则导线中流过的电子为_____mol。
(3)若该装置的电解质溶液换为FeCl3溶液,其正极反应为_______。
Ⅱ.向2L密闭容器中通入amol气体A和b mol气体B,在一定条件下发生反应xA(g)+yB(g)![]() pC(g)+qD(g)。已知:平均反应速率v(C)=
pC(g)+qD(g)。已知:平均反应速率v(C)=![]() v(A);反应至2min时,A的物质的量减少了
v(A);反应至2min时,A的物质的量减少了![]() ,B的浓度减少了
,B的浓度减少了![]() amol/L,同时有amolD生成。
amol/L,同时有amolD生成。
(4)0~2 min内,v(A)=__________。
(5)该化学方程式中,y=__________。
(6)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率____(填“增大”、“减小”或“不变”),理由是_____。
【答案】原电池 Zn+Cu2+=Zn2++Cu 颜色变浅 0.04 Fe3++e-=Fe2+ ![]() amol/(L·min) 3 增大 体积减小,反应物的浓度增大,则反应速率增大
amol/(L·min) 3 增大 体积减小,反应物的浓度增大,则反应速率增大
【解析】
I.(1)装置是否有外加电源可以判断所属的类别,根据电池的工作原理来分析电极附近的现象;
(2)根据电极反应式来计算;
(3)电池中的电解质溶液换为FeCl3溶液时,电池反应为Zn+2Fe3+=Zn2++2Fe2+。
II.(4)根据反应速率的概念计算;
(5)速率之比等于化学计量数之比,物质的量之比等于化学计量数之比;
(6)如果其他条件不变,将容器的容积变为1L,进行同样的实验,体积减小,反应物的浓度增大,因而使反应速率增大。
I.(1)装置没有外加电源,有活动性不同的电极、电解质溶液、形成了闭合回路,属于原电池,活泼金属锌作负极,本身失电子,发生反应:Zn-2e-=Zn2+,正极上是Cu2+得电子,正极的电极反应式为Cu2++2e-=Cu,所以Cu2+在该极附近溶度减小,溶液的蓝色变浅,正极反应和负极反应合并即为总的电池反应Zn+Cu2+= Zn2++Cu;
(2)锌极发生的反应为:Zn-2e-=Zn2+,锌片质量减少1.3g,反应的Zn的物质的量为n(Zn)=1.3g÷65g/mol=0.02mol时,由于Zn是+2价的金属,所以反应过程中转移电子物质的量为0.04mol。
(3)若该装置的电解质溶液换为FeCl3溶液,根据总反应:Zn+2Fe3+=Zn2++2Fe2+,可知正极发生还原反应的电极反应式为Fe3++e-=Fe2+;
II.(4)反应2min 时,A的物质的量减少了![]() ,则△c(A)=
,则△c(A)=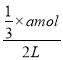 =
=![]() mol/L,0~2min内,v(A)=
mol/L,0~2min内,v(A)=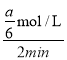 =
=![]() mol/(L·min);
mol/(L·min);
(5)平均反应速率v(C)=![]() v(A),则x:p=2:1,A的物质的量减少了
v(A),则x:p=2:1,A的物质的量减少了![]() ,则消耗的A为
,则消耗的A为![]() ,B的物质的量减少了
,B的物质的量减少了![]() ,有a mol D生成,则x:y:q=
,有a mol D生成,则x:y:q=![]() mol:
mol:![]() mol:amol=2:3:6,所以x:y:p:q=2:3:1:6,因此反应方程式为:2A(g)+3B(g)═1C(g)+6D(g),y=3;
mol:amol=2:3:6,所以x:y:p:q=2:3:1:6,因此反应方程式为:2A(g)+3B(g)═1C(g)+6D(g),y=3;
(6)如果其他条件不变,将容器的容积变为1L,进行同样的实验,体积减小,反应物的浓度增大,因而使反应速率增大。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案