题目内容
【题目】随原子序数递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
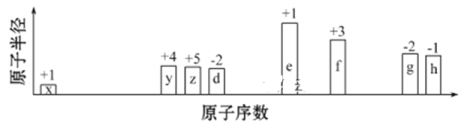
根据判断出的元素回答问题:
(1) f在周期表中的位置是__________。
(2) 比较d、e常见离子的半径大小(用化学式表示,下同):____>____;比较g、h的最高价氧化物对应水化物的酸性强弱:____>____。
(3) 任选上述元素组成一种四原子共价化合物,写出其电子式:____。
(4)f和h形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该化合物是_______(填“共价化合物”或“离子化合物”) , 可以证明你的判断正确的实验依据是________________。
(5) 上述元素可组成盐R: zx4f(gd4)2,向盛有10 mL 1 mol·L-1R溶液的烧杯中滴加1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
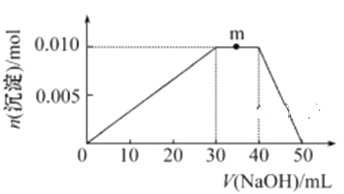
①m点反应的离子方程式: ________________。
②若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
【答案】第3周期ⅢA族 r(O2-) r(Na+) HClO4 H2SO4 ![]() 共价化合物 熔融时不导电 NH4++OH-=NH3·H2O 0.022
共价化合物 熔融时不导电 NH4++OH-=NH3·H2O 0.022
【解析】
根据图中d、g元素的最低价态均为-2价,首先判断出d为O,g为S。其它元素依据其价态可依次推出,其中x为H,y为C,z为N,e为Na,f为Al,h为Cl。
(1)在表述元素在周期表中的位置时要说明所在的周期和所在的族。
(2)比较离子半径大小,首先比较电子层数的多少,然后看核电荷数大小;比较最高价氧化物水化物的酸性强弱时,可以从非金属性强弱入手分析。
(3)既是任写一种,当然写自己最熟悉的,比如NH3;
(4)共价化合物往往依靠分子间作用力聚集,熔、沸点较低。通常用化合物在熔融情况下的导电性来判断是离子化合物还是共价化合物。
(5)用好题图信息,明确反应的先后顺序。
(1)f为Al,在元素周期表的第3周期,第IIIA族;
(2)d、e常见离子为O2-、Na+,它们都是10电子微粒,此时核电荷数越大,半径越小,所以离子半径:r(O2-)>r(Na+);g为S,h为Cl,它们的最高价氧化物对应水化物的化学式为分别为:H2SO4、HClO4,其酸性强弱是HClO4>H2SO4;
(3)上述元素形成的四原子共价化合物可以是NH3、HCHO、AlCl3等,比如NH3的电子式表达为:![]() ;
;
(4)f和h形成AlCl3,熔点低、易升华说明它是共价化合物;判断一个化合物是离子化合物还是共价化合物,通常可以测其在熔融情况下的导电性,如果该化合物能导电,则为离子化合物,如该化合物不能导电,则为共价化合物;
(5)①上述元素形成的盐R的化学式为NH4Al(SO4)2,加入NaOH溶液后,从沉淀的生成、溶解与消耗NaOH量的关系可以看出,发生反应的先后顺序是:Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3·H2O,Al(OH)3+OH-=AlO2-+2H2O;所以m处发生反应的离子方程式为:NH4++OH-=NH3·H2O;
②NH4Al(SO4)2的物质的量为0.01mol,其中含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol;Ba(OH)2的物质的量为0.024mol,其中含有Ba2+0.024mol,OH-0.048mol。反应生成的BaSO4沉淀的物质的量为0.02mol(Ba2+过量,用完全反应的SO42-计算所得);据题图可知OH-涉及的反应有先后,先发生反应:Al3++3OH-=Al(OH)3↓,此时Al3+完全反应,消耗OH-的物质的量为0.03mol,接着发生反应:NH4++OH-=NH3·H2O,此时NH4+完全反应,消耗OH-的物质的量为0.01mol,最后剩余的OH-0.008,将部分Al(OH)3溶解:
Al(OH)3+OH-=AlO2-+2H2O
0.01mol 0.008mol
所以Al(OH)3未溶解的物质的量为:0.01mol-0.008mol=0.002mol,所以最后溶液中沉淀的物质的量为:n(BaSO4)+n[Al(OH)3]余=0.02mol+0.002mol=0.022mol。

 阅读快车系列答案
阅读快车系列答案【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经150年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___;
(2)元素①的单质电子式为____。
(3)比较③、⑤元素的金属性强弱___>___;并写出它们最高价氧化物对应的水化物间反应的化学方程式____。
(4)上述元素的最高价氧化物对应的水化物中,酸性最强的是____。
(5)在元素③、④、⑤、⑦、⑧形成的简单离子中,半径最小的是_____;
(6)工业制取⑥的单质的反应的化学方程式为_______。