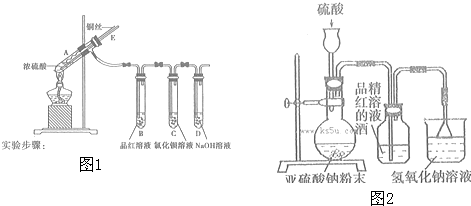
题目内容
6.在Zn、ZnO、ZnCO3、盐酸、CuCl2和CaCl2溶液六种物质中,每两种物质反应能生成ZnCl2的方法有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 Zn与盐酸、CuCl2反应,ZnO、ZnCO3均与盐酸反应,以此来解答.
解答 解:由Zn的活泼性大于H、Cu可知,Zn与盐酸、CuCl2溶液发生置换反应均可生成ZnCl2,
由复分解反应的条件可知,金属氧化物、碳酸盐均与盐酸反应,则ZnO、ZnCO3均与盐酸反应生成ZnCl2,
其他物质之间不反应,则每两种物质反应能生成ZnCl2的方法有4种,
故选C.
点评 本题考查金属及化合物的性质,为高频考点,把握金属发生的置换反应及复分解反应为解答的关键,注意物质的性质及反应的分析,侧重元素化合物知识的综合考查,题目较简单.

练习册系列答案
相关题目
11.常见有机反应类型有:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥氧化反应 ⑦还原反应,其中可能在有机分子中引入羟基的反应类型是( )
| A. | ①②④ | B. | ⑤⑥⑦ | C. | ①②⑦ | D. | ③④⑤ |
15.断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出的四种毒素的结构式,下列推断正确的是( )


| A. | ①和②、③与④分别互为同分异构体 | |
| B. | ①、③互为同系物 | |
| C. | ①、②、③、④均能与氢氧化钠溶液反应 | |
| D. | 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
16.向某无色溶液中加入铝片能放出氢气,则此溶液中一定能大量共存的离子组是( )
| A. | Ba2+、Cl-、Na+、K+ | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、SO32-、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
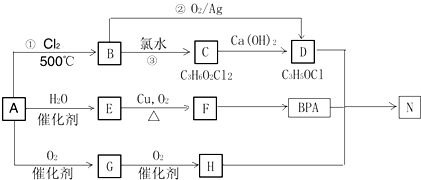
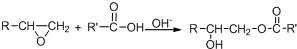
 .
.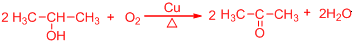 .
.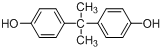 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
.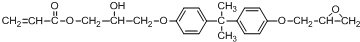
 (其中两种).
(其中两种).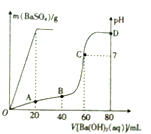 常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示.
常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示. 2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题: