题目内容
【题目】一种工业制备SrCl2·6H2O的生产流程如下:
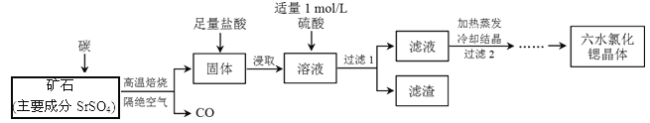
已知:①M(SrCl2·6H2O)=267 g/mol;
② Kap(SrSO4)= 3.3×10-7、Kap(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质。
(1)隔绝空气高温焙烧,若2 mol SrSO4中只有S被还原,转移了16mol电子。写出该反应的化学方程式:_____________________________________________。
(2)过滤2后还需进行的两步操作是______、_________。
(3)加入硫酸的目的是_________________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_______________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为____________(保留4位有效数字)。
【答案】(1)SrSO4+4C![]() SrS+4CO↑;(2)洗涤;干燥;(3)除去Ba2+杂质;0.03;
SrS+4CO↑;(2)洗涤;干燥;(3)除去Ba2+杂质;0.03;
(4)①加入最后一滴标准液,溶液由无色变为红色,且30s不褪色 ②93.45%。
【解析】
试题分析:(1)隔绝空气高温焙烧,若2 mol SrSO4中只有S被还原,转移了16mol电子。则每1molS 获得8mol电子,元素化合价降低8价,由于原来是+6价,所以反应后变为-2价,根据电子守恒、原子守恒,则该反应的化学方程式是SrSO4+4C![]() SrS+4CO↑;(2)过滤2后的溶液为SrCl2,该物质的溶解度随温度的升高而增大,随温度的降低而减小,所以从溶液中获得SrCl2·6H2O,还需进行的两步操作是洗涤;干燥,就得到纯净的SrCl2·6H2O,(3)由于BaSO4是难溶于水的物质,所以在操作过程中加入硫酸目的是使溶液中的Ba2+形成BaSO4沉淀,而除去Ba2+杂质;Kap(BaSO4)=1.1×10-10,由于溶液中Ba2+浓度为1×10-5 mol/L,则c(SO42-)=1.1×10-10÷1×10-5 mol/L=1.1×10-5 mol/L,根据Kap(SrSO4)= 3.3×10-7可知c(Sr2+)=3.3×10-7÷1.1×10-5 mol/L=3.0×10-2 mol/L=0.03mol/L;(4)①若NH4SCN不再与剩余的Ag+结合形成AgSCN白色沉淀,溶液中就会含有SCN-,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时再滴加最后一滴溶液,溶液由无色变为血红色,且30 s不褪色;②n(NH4SCN)= 0.2000 mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,1.000g产品中SrCl26H2O的物质的量为:n(SrCl26H2O)=1/2 n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=33.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:(0.9435g÷1g)×100%=93.45%。
SrS+4CO↑;(2)过滤2后的溶液为SrCl2,该物质的溶解度随温度的升高而增大,随温度的降低而减小,所以从溶液中获得SrCl2·6H2O,还需进行的两步操作是洗涤;干燥,就得到纯净的SrCl2·6H2O,(3)由于BaSO4是难溶于水的物质,所以在操作过程中加入硫酸目的是使溶液中的Ba2+形成BaSO4沉淀,而除去Ba2+杂质;Kap(BaSO4)=1.1×10-10,由于溶液中Ba2+浓度为1×10-5 mol/L,则c(SO42-)=1.1×10-10÷1×10-5 mol/L=1.1×10-5 mol/L,根据Kap(SrSO4)= 3.3×10-7可知c(Sr2+)=3.3×10-7÷1.1×10-5 mol/L=3.0×10-2 mol/L=0.03mol/L;(4)①若NH4SCN不再与剩余的Ag+结合形成AgSCN白色沉淀,溶液中就会含有SCN-,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时再滴加最后一滴溶液,溶液由无色变为血红色,且30 s不褪色;②n(NH4SCN)= 0.2000 mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,1.000g产品中SrCl26H2O的物质的量为:n(SrCl26H2O)=1/2 n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=33.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:(0.9435g÷1g)×100%=93.45%。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案