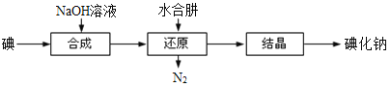
题目内容
【题目】(1)在有机化学中广泛采用系统命名法,根据系统命名法原则,回答下列问题:
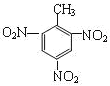
①系统命名法命名下列物质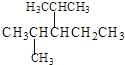 ___;
___;
②3,4-二甲基-2-戊烯的结构简式是___;
(2)![]() 中含有的官能团的名称为__。
中含有的官能团的名称为__。
(3)按要求书写下列化学方程式:
①甲苯制备TNT___;
②实验室制备乙烯___。
(4)下列物质的沸点按由高到低的顺序排列正确的是__。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.②④③① C.②④①③ D.④②①③
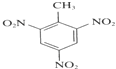
(5)现有下列6种与人们生产生活相关的有机物:①CH3COOH(调味剂)②HCOOCH3(烟草熏蒸剂)③![]() (制酚醛树脂)④
(制酚醛树脂)④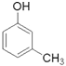 (生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
(生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
【答案】2,4-二甲基-3-乙基戊烷 CH3CH=C(CH3)CH(CH3)2 羟基、酯基 ![]() +3HO-NO2
+3HO-NO2![]()
 +3H2O CH3CH2OH
+3H2O CH3CH2OH![]() CH2=CH2↑+H2O C ②
CH2=CH2↑+H2O C ②
【解析】
(1)①烷烃命名时,选最长的碳链为主链,当有多条主链可以选择时,应选择支链多的一条,故主链上有5个碳原子,为戊烷,从离支链近的一端给主链上的碳原子进行编号,故在2号和4号碳原子上各有一个甲基,在3号碳原子上有一个乙基,故名称为2,4-二甲基-3-乙基戊烷,故答案为:2,4-二甲基-3-乙基戊烷;
②3,4-二甲基-2-戊烯的主链上有5个碳原子在2号和3号碳原子之间有碳碳双键,在3号和4号碳原子上各有一个甲基,结构简式为CH3CH=C(CH3)CH(CH3)2,故答案为:CH3CH=C(CH3)CH(CH3)2;
(2)![]() 中含官能团为羟基和酯基,故答案为:羟基、酯基;
中含官能团为羟基和酯基,故答案为:羟基、酯基;
(3)①甲苯和浓硝酸在浓硫酸做催化剂、加热的条件下发生硝化反应制取三硝基甲苯即TNT,化学方程式为![]() +3HNO3
+3HNO3 ![]()
 +3H2O,故答案为:
+3H2O,故答案为:![]() +3HNO3
+3HNO3 ![]()
 +3H2O;
+3H2O;
②实验室用乙醇和浓硫酸共热至170℃制备乙烯,化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O,故答案为:CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(4)给出的物质都是烷烃,烷烃随着分子中碳原子数的递增,沸点逐渐升高;碳原子数相同的烷烃,支链越多,熔、沸点越低,由②④中含有5个碳原子,①③中含有4个碳原子,故②④的沸点高于①③,而①中没有支链,③中1个支链,故沸点①>③;而②中无支链,④中有1个支链,所以②沸点最高,③沸点最低,④沸点高于①,故沸点由高到低为②④①③,故选C;
(5)分子式相同而结构不同的化合物间互为同分异构体,故和①CH3COOH互为同分异构体的是②,故答案为:②。

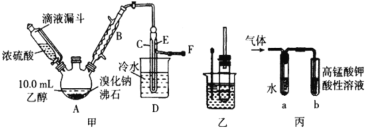
【题目】某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。下列说法正确的是
试管 | ① | ② | ③ | ④ |
实验现象 | 溶液仍为无色,有白雾、白色固体产生 | 有大量白色沉淀产生 | 有少量白色沉淀产生 | 品红溶液褪色 |
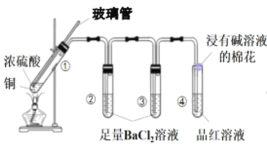
A.②中白色沉淀是BaSO3
B.①中可能有部分浓硫酸挥发了
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
【题目】有机物A的相对分子质量不超过150,经测定可知A具有下列性质:
A所具有的性质 | 由此推出的A的组成或结构 |
①A能燃烧,燃烧产物只有CO2和H2O | |
②A与醇或羧酸在浓硫酸存在条件下发生反应均能生成有香味的物质 | |
③在一定条件下,A能发生分子内的脱水反应,生成物能使溴的CCl4溶液退色 | |
④0.1 mol A与足量NaHCO3溶液反应放出标准状况下4.48L气体 |
(1)填写表中空白_____________、__________________ 、_______________________。
(2)已知A分子中氧元素的质量分数为59.7%,则A的分子式为______________。
(3)假设A的结构式中不含碳支链,写出③中A所发生反应的化学方程式:__________________。
【题目】根据金属活动性顺序表,Cu不能发生:Cu+2H2O===Cu(OH)2+H2↑的反应,但选择恰当的电极材料和电解质溶液进行电解,这个反应就能实现。下列四组电极和电解质溶液中,能实现该反应最为恰当的一组是( )
A | B | C | D | |
阳极 | 石墨棒 | Cu | Cu | Cu |
阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
电解质 溶液 | CuSO4 溶液 | Na2SO4 溶液 | H2SO4 溶液 | CuSO4 溶液 |
A.AB.BC.CD.D