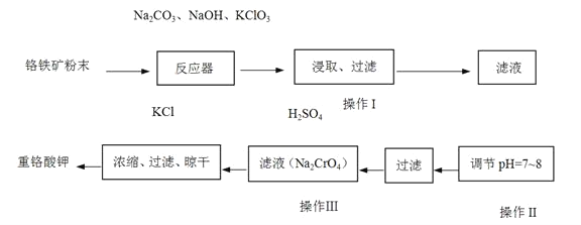
题目内容
【题目】用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol·L-1FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

(1)用KSCN溶液检验出Fe3+的现象是_______________________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _____________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:

①NaCl溶液的浓度是________ mol·L-1。
②Ⅳ中检测Cl2的实验方法:______________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________。
【答案】溶液变红 2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl- 还原 0.2 取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝 通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了Fe2+先于Cl-放电
【解析】
(1)依据溶液中的Fe3+的检验方法与原理回答;
(2)依据电解原理书写阳极氯离子失电子的电极反应,生成的Cl2能将Fe2+氧化为Fe3+,据此写出离子方程式;
(3)阳极可发生氧化反应,依据氧化还原规律分析;
(4)①保证电解FeCl2与NaCl时溶液中c(Cl-)相同;
②利用淀粉KI试纸可检验氯气的存在;
③依据对照思想,找出产生上述现象的因素,结合电解原理中电解质溶液的离子放电顺序作答。
(1)SCN-与Fe3+发生反应生成Fe(SCN)3而使溶液变成红色,常根据这一颜色变化检验溶液中的Fe3+,
故答案为:溶液变红;
(2)实验Ⅰ中阳极附近出现黄色,有气泡产生,则该气体应为Cl2,Cl2将Fe2+氧化成Fe3+,有关反应为2Cl--2e-===Cl2↑,Cl2+2Fe2+===2Cl-+2Fe3+,
故答案为:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-;
(3)电解过程中,阳极发生氧化反应,由于Fe2+具有还原性,若其浓度较大,可能在阳极失去电子发生氧化反应生成Fe3+,
故答案为:还原。
(4)①pH=1的0.1 mol·L-1的FeCl2溶液中,c(Cl-)=0.2mol·L-1,根据控制变量法的原理,必须保证电解时溶液中c(Cl-)相同,则pH=1的NaCl溶液中c(NaCl)应为0.2 mol·L-1,
故答案为:0.2;
②Cl2具有强氧化性,可取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝,
故答案为:取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝;
③对比实验Ⅱ和Ⅳ、Ⅴ可知,电极附近出现黄色可能是由于生成Fe3+、Cl2所致,通过控制电压,证明产生Fe3+的两种原因都成立,同时也验证了Fe2+先于Cl-放电,
故答案为:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了Fe2+先于Cl-放电。